题目内容
3. 二氧化氯(ClO2)正逐步代替Cl2成为公认的高效、广谱、安全的水处理剂.当自来水厂用ClO2处理后水中含ClO2在0.1~0.8mg•L-1之间时,即达到合格标准.
二氧化氯(ClO2)正逐步代替Cl2成为公认的高效、广谱、安全的水处理剂.当自来水厂用ClO2处理后水中含ClO2在0.1~0.8mg•L-1之间时,即达到合格标准.(1)ClO2在水处理过程中的主要作用是杀菌消毒,表现出的性质是氧化性(填“氧化性”或“还原性”).
(2)制取ClO2的传统方怯是利用KClO3与SO2反应,反应中SO2作还原剂,这说明氧化性是KClO3>ClO2(填“>”或“<”)每生成1molClO2,转移的电子数为1mol.
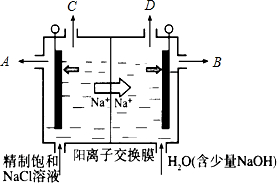
(3)制取ClO2的新方法是利用阳离子交换膜在特定条件下电解饱和食盐水.图中电极室被阳离子交换膜分为左、右两室.右室为阴极(填“阳极”或“阴极”),电解过程中右室溶液的pH逐渐增大(填“增大”或“减小”)原因是阴极电极反应式:2H++2e-=H2↑,电解中阴极H+浓度减小,使得H2O?OH-+H+的平衡向右移动,溶液的pH增大(写出电极反应是,并结合水的电离平衡加以文字说明).C处收集的气体是ClO2(填化学式,下同)A处得到的溶液中,溶质除NaCl外主要为HCl.
(4)碘量法可检测自来水中ClO2的浓度.取10.00mL水样,加入稍过量的碘化钾溶液,发生反应2ClO2+2I-═2ClO2+I2;然后用淀粉溶液作指示剂,滴加1.0×10-8mol•L-1的Na2S2O3溶液至溶液由蓝色变为无色,且半分钟颜色不再变化时停止滴加(已知2S2O32-+I2═S4O82-+2I-)
分析 (1)依据二氧化氯具有强的氧化性,能够杀菌消毒的性质解答;
(2)反应中氯酸钾中的氯从+5价降为二氧化氯中+4价,降3价,二氧化硫中+4价硫化合价升高为+6价,依据氧化还原反应得失电子守恒规律计算转移电子数目;
(3)电解质中阳离子移向阴极;阴极上水中的氢离子失去电子生成氢气,依据水的电离平衡移动影响因素判断,溶液pH变化;阳极氯离子失去电子发生氧化反应生成二氧化氯,同时生成氢离子,据此解答;
(4)碘遇淀粉变蓝色,故选择淀粉作指示剂,当溶液由蓝色变为无色,且半分钟颜色不再变化说明滴定到达终点;
解答 解;(1)二氧化氯具有强的氧化性,能够杀菌消毒,在水处理过程中的主要作用:杀菌消毒,表现氧化性;
故答案为:杀菌消毒;氧化性;
(2)反应中氯酸钾中的氯从+5价降为二氧化氯中+4价,降3价,二氧化硫中+4价硫化合价升高为+6价,所以二氧化硫在反应中做还原剂,对应硫酸根为氧化产物,氯酸钾做氧化剂,氧化还原反应中氧化剂氧化性大于还原产物氧化性,可知:KClO3>ClO2;生成1mol二氧化氯,则须1mol氯从+5价降为+4价,得到1mol电子;
故答案为:还原;>;1mol;
(3)由题意可知:电解过程中,阳离子钠离子移向右室,所以右室为阴极;电解过程中,阴极氢离子失去电子生成氢气,电极反应使:2H++2e-=H2↑,电解中阴极H+浓度减小,使得H2O?OH-+H+的平衡向右移动,溶液的pH增大;左室为阳极,氯离子在阳极失去电子发生氧化反应生成二氧化率,电极反应式:Cl--5e-+2H2O=ClO2↑+4H+,左室产生二氧化氯气体,同时生成氯化氢,氯化氢水溶液为盐酸,所以从C处出来的为二氧化氯,从A处得到的溶液中,溶质除NaCl外主要为氯化氢;
故答案为:阴极;增大;阴极电极反应式:2H++2e-=H2↑,电解中阴极H+浓度减小,使得H2O?OH-+H+的平衡向右移动,溶液的pH增大;ClO2;HCl;
(4)碘遇淀粉变蓝色,故选择淀粉作指示剂,判定达到滴定终点的现象是当溶液由蓝色变为无色,且半分钟颜色不再变化;
故答案为:溶液由蓝色变为无色,且半分钟颜色不再变化;
点评 本题为综合题,考查了氯及其化合物性质,涉及氧化还原反应分析、转移电子数计算、电解池电极反应式书写、氧化还原滴定原理,明确氧化还原反应规律及电解池工作原理是解题关键,题目难度中等.

| A. | 标准状况下,22.4LH2O所含电子数为10NA | |
| B. | 0.1mol/LBa(OH)2溶液中含有0.2NA个OH- | |
| C. | 0.5molNH4HSO4晶体中,含有H+数目约为0.5NA | |
| D. | 常温常压下,3.2gO3混合气体含有0.2NA个氧原子 |
| A. | 硫酸亚铁与氢氧化钠溶液混合生成氢氧化亚铁和硫酸钠的反应属于氧化还原反应 | |
| B. | Fe0与一氧化碳反应得到单质铁属于置换反应 | |
| C. | 在自然界中不存在铁单质 | |
| D. | 炽热的铁丝在充满氧气的集气瓶中发生化合反应 |
| A. | 0.533L | B. | 0.267L | C. | 4.0L | D. | 2.0L |
| A. | 凡是单质参加的化合反应都是氧化还原反应 | |
| B. | 碱性氧化物均是金属氧化物 | |
| C. | 金属单质在参加的反应中只能作还原剂 | |
| D. | 非金属单质在参加的反应中只能作氧化剂 |


 ,D是
,D是 ,E是
,E是 ,G是
,G是 .
. .
. .
.