题目内容
17.下列物质的转化在给定条件下能实现的是( )| A. | NH3$→_{催化剂、加热}^{O_{2}}$NO2$\stackrel{H_{2}O}{→}$HNO3 | |
| B. | 海水$\stackrel{石灰乳}{→}$Mg(OH)2$\stackrel{HCi(aq)}{→}$MgCl2(aq)$\stackrel{△}{→}$ 无水MgCl2 | |
| C. | Al2O3$\stackrel{HCl(aq)}{→}$AlCl3(aq)$\stackrel{NH_{3}•H_{2}O}{→}$ 固体Al(OH)3 | |
| D. | CH2═CH2$→_{催化剂}^{H_{2}O}$CH3CH2OH$→_{△}^{CuO}$CH3COOH |
分析 A.氨气催化氧化反应生成NO;
B.氯化镁加热水解生成挥发性的盐酸,所以得不到无水MgCl2;
C.Al2O3与盐酸反应生成氯化铝和水,氯化铝溶液和氨水反应生成氢氧化铝沉淀和氯化铵;
D.CH3CH2OH催化氧化生成乙醛.
解答 解:A.氨气被催化氧化生成NO,不能直接生成NO2,故A错误;
B.海水中的MgCl2与石灰乳反应生成氢氧化镁,氢氧化镁与盐酸反应生成MgCl2溶液,但由于Mg2+水解Mg2++2H2O?Mg(OH)2+2H+,加热蒸发HCl挥发,平衡向右移动,所以得不到无水MgCl2,故B错误;
C.Al2O3与盐酸反应生成氯化铝和水,氯化铝溶液和氨水反应生成氢氧化铝沉淀和氯化铵,故C正确;
D.乙烯和水发生加成反应生成乙醇,CH3CH2OH催化氧化生成乙醛,故D错误;
故选C.
点评 本题考查了元素化合物性质,物质转化关系的分析应用,掌握基础是关键,需要熟练掌握物质性质,题目难度中等.

练习册系列答案
相关题目
19.已知常温下Ksp[Cu(OH)2]=2.2×10-20mol3•L-3、Ksp[Al(OH)3]=1.3×10-33mol4•L-4、Ksp[Fe(OH)3]=4.0×10-38mol4•L-4.某1L溶液中含有Cu2+、Al3+、Fe3+、H+,浓度均为1.0×10-2mol•L-1,向该溶液中加入少量的NaOH固体,测得溶液的pH=3,溶液的体积变化忽略不计.下列有关叙述正确的是( )
| A. | 有Al(OH)3、Fe(OH)3沉淀析出 | |
| B. | 所得混合液中:$\frac{c(A{l}^{3+})}{c(F{e}^{3+})}$=3.25×104 | |
| C. | 所得混合液中相关微粒的浓度大小:c(Cu2+)=c(Al3+)>c(Fe3+)>c(H+) | |
| D. | 若向原溶液中逐滴加入NaOH溶液,最后析出的是Cu(OH)2沉淀 |
9.在一定温度下,在恒压的密闭容器中进行的可逆反应A(g)+3B(g)?2C(g)达到平衡的标志是( )
| A. | 混合气体密度保持不变 | |
| B. | 单位时间内生成n mol A,同时生成3n mol B | |
| C. | 混合气体的压强保持不变 | |
| D. | C生成的速率与A分解的速率相等 |
6.下列说法正确的是( )
| A. | 晶体在受热熔化过程中一定存在化学键的断裂 | |
| B. | 原子晶体的原子间只存在共价键,而分子晶体内只存在范德华力 | |
| C. | 区分晶体和非晶体最科学的方法是对固体进行X-射线衍射实验 | |
| D. | 非金属元素的原子间只形成共价键,金属元素的原子非金属元素的原子间只形成离子键 |
7.把元素周期表中第16号元素和第6号元素的原子相比较,下列数据中前者是后者的4倍的是( )
| A. | 电子数 | B. | 最外层电子数 | C. | 中子数 | D. | 次外层电子数 |
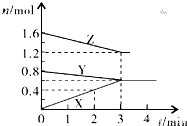 某温度时,在2L密闭容器中,X、Y、Z三种物质的物质的量随间变化的曲线如图所示.由图中数据分析
某温度时,在2L密闭容器中,X、Y、Z三种物质的物质的量随间变化的曲线如图所示.由图中数据分析
 “8•12”天津港危化仓库爆炸,造成生命、财产的特大损失.据查危化仓库中存有大量的钠、钾,硝酸铵和氰化钠(NaCN).请回答下列问题:
“8•12”天津港危化仓库爆炸,造成生命、财产的特大损失.据查危化仓库中存有大量的钠、钾,硝酸铵和氰化钠(NaCN).请回答下列问题: .
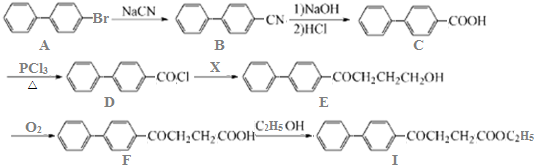
.
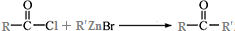
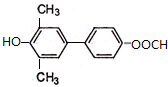 .
.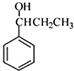 )为强效利胆药,请写出以甲苯和C2H5ZnBr为原料制备苯丙醇的合成路线流程图(无机试剂可任选).合成路线流程图示例如下:
)为强效利胆药,请写出以甲苯和C2H5ZnBr为原料制备苯丙醇的合成路线流程图(无机试剂可任选).合成路线流程图示例如下: