题目内容
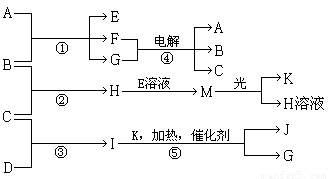
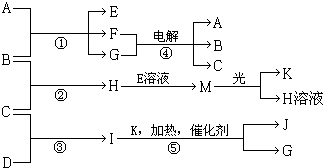 物质A、E、F的焰色反应呈黄色,物质I的1个分子由4个原子组成并共含有10个电子,B、C、D、K在常温下都是气体单质,G在常温下是无色液体,反应①~⑤都是用于工业生产的反应,各有关物质之间的相互反应转化关系如图所示(部分反应条件已略去):
物质A、E、F的焰色反应呈黄色,物质I的1个分子由4个原子组成并共含有10个电子,B、C、D、K在常温下都是气体单质,G在常温下是无色液体,反应①~⑤都是用于工业生产的反应,各有关物质之间的相互反应转化关系如图所示(部分反应条件已略去):(1)写出物质的化学式:B
(2)写出A物质的电子式
(3)0.1mol/L E水溶液中各离子浓度由大到小的顺序为
(4)反应④阴极电极反应式
反应①的离子方程式
反应⑤的化学方程式
分析:I的分子由4个原子组成并共含有10个电子,应为NH3.G在常温下是无色液体,应为H2O,由转化关系可知反应⑤应为氨气的催化氧化,则K为O,J为NO.物质A、E、F的焰色反应呈黄色,应都含有钠元素,M在光照条件下可生成O2,应为HClO,则H为HCl,结合转化关系可知,B为Cl2,C为H2,D为N2,E为NaClO,A为NaOH,F为NaCl,据此解答.
解答:解:I的分子由4个原子组成并共含有10个电子,应为NH3.G在常温下是无色液体,应为H2O,由转化关系可知反应⑤应为氨气的催化氧化,则K为O,J为NO.物质A、E、F的焰色反应呈黄色,应都含有钠元素,M在光照条件下可生成O2,应为HClO,则H为HCl,结合转化关系可知,B为Cl2,C为H2,D为N2,E为NaClO,A为NaOH,F为NaCl,
(1)由以上分析可知B为Cl2,M为HClO,故答案为:Cl2;HClO;
(2)A为NaOH,其电子式为: ,故答案为:
,故答案为: ;
;
(3)0.1mol/LNaClO水溶液中ClO-水解,溶液呈碱性,故离子浓度由大到小的顺序为:c(Na+)>c(ClO-)>c(OH-)>c(H+),
故答案为:c(Na+)>c(ClO-)>c(OH-)>c(H+);
(4)反应④阴极发生还原反应,水在阴极放电生成氢气与氢氧根,电极反应式为:2H2O+2e-=H2↑+2 OH-;
反应①为氯气和氢氧化钠的反应,反应的离子方程式为:Cl2+2OH-=Cl-+ClO-+H2O;
反应⑤为氨气的催化氧化反应,反应的化学方程式为:4NH3+5O2
4NO+6H2O,
故答案为:2H2O+2e-=H2↑+2 OH-;Cl2+2OH-=Cl-+ClO-+H2O;4NH3+5O2
4NO+6H2O.;
(1)由以上分析可知B为Cl2,M为HClO,故答案为:Cl2;HClO;
(2)A为NaOH,其电子式为:
 ,故答案为:
,故答案为: ;
;(3)0.1mol/LNaClO水溶液中ClO-水解,溶液呈碱性,故离子浓度由大到小的顺序为:c(Na+)>c(ClO-)>c(OH-)>c(H+),
故答案为:c(Na+)>c(ClO-)>c(OH-)>c(H+);
(4)反应④阴极发生还原反应,水在阴极放电生成氢气与氢氧根,电极反应式为:2H2O+2e-=H2↑+2 OH-;
反应①为氯气和氢氧化钠的反应,反应的离子方程式为:Cl2+2OH-=Cl-+ClO-+H2O;
反应⑤为氨气的催化氧化反应,反应的化学方程式为:4NH3+5O2
| ||
| △ |
故答案为:2H2O+2e-=H2↑+2 OH-;Cl2+2OH-=Cl-+ClO-+H2O;4NH3+5O2
| ||
| △ |
点评:本题考查无机物的推断,题目难度中等,I、G为解答该题的突破口,注意把握反应的转化关系的重要信息,侧重于学生分析能力的考查,注意相关知识的学习.

练习册系列答案
 孟建平小学滚动测试系列答案
孟建平小学滚动测试系列答案
相关题目