��Ŀ����
3��E��F��I��״���������嵥�ʣ�����EΪ���ݼ�����ζ�����壬X��Y�dz����Ľ������ʣ��μӷ�Ӧ��ˮ�Լ����ɵ�ˮ��ͼ������ȥ��
��д���пհף�
��1��E��Cl2��J��Fe��OH��3����д��ѧʽ��
��2��д��D+X��F+G�����ӷ���ʽ��2Al+2H2O+2OH-=2AlO2-+3H2����
��3��д��A+B��C+E�Ļ�ѧ����ʽ��NaClO+2HCl=NaCl+Cl2��+H2O��
���� ת����ϵ��E��F��I��״���������嵥�ʣ�EΪ���ݼ�����ζ�����壬X��Y�dz����Ľ������ʣ�E��Y��Ӧ����K��Һ��K+Y=L��˵������Ϊ��۽�����Y�dz����Ľ��������ж�ΪFe������E�д̼�����ζ��������Ӧ�ƶ�EΪCl2��KΪFeCl3��LΪFeCl2�����ݷ�ӦL��FeCl2��+Na2O2��J+H+C��JΪ��������JΪFe��OH��3��I�����嵥���ж�ΪO2��CΪNaCl��C��Һ�������E��F��D��D����Һ������FΪH2��DΪNaOH��D��X����F��G�����ж�XΪAl��GΪNaAlO2��K��G����˫ˮ���HΪAl��OH��3��A��B����2��1��Ӧ����C��E�������ķ�ӦΪ��NaClO+2HCl=NaCl+Cl2��+H2O������AӦΪHCl��BΪNaClO���ݴ˴��⣮
��� �⣺ת����ϵ��E��F��I��״���������嵥�ʣ�EΪ���ݼ�����ζ�����壬X��Y�dz����Ľ������ʣ�E��Y��Ӧ����K��Һ��K+Y=L��˵������Ϊ��۽�����Y�dz����Ľ��������ж�ΪFe������E�д̼�����ζ��������Ӧ�ƶ�EΪCl2��KΪFeCl3��LΪFeCl2�����ݷ�ӦL��FeCl2��+Na2O2��J+H+C��JΪ��������JΪFe��OH��3��I�����嵥���ж�ΪO2��CΪNaCl��C��Һ�������E��F��D��D����Һ������FΪH2��DΪNaOH��D��X����F��G�����ж�XΪAl��GΪNaAlO2��K��G����˫ˮ���HΪAl��OH��3��A��B����2��1��Ӧ����C��E�������ķ�ӦΪ��NaClO+2HCl=NaCl+Cl2��+H2O������AӦΪHCl��BΪNaClO��
��1����������ķ�����֪��EΪCl2��JΪFe��OH��3��
�ʴ�Ϊ��Cl2��Fe��OH��3��
��2��D+X��F+G�ķ�ӦΪ�����������Ƶķ�Ӧ����Ӧ�����ӷ���ʽΪ2Al+2H2O+2OH -=2AlO2-+3H 2����
�ʴ�Ϊ��2Al+2H2O+2OH -=2AlO2-+3H2����
��3��A+B��C+E�Ļ�ѧ����ʽΪNaClO+2HCl=NaCl+Cl2��+H2O��
�ʴ�Ϊ��NaClO+2HCl=NaCl+Cl2��+H2O��
���� ��ͬ����������ת����ϵ���������ʣ���Ӧ����ͷ�Ӧ�����ķ����жϣ���Ҫ�ǽ�����۷��������ԭ��Ӧ�ã�������ԭ��Ӧ���ɵ�Ӧ�ã��������������ǹؼ�����Ŀ�ѶȽϴ�

| �� ���� | ��A | ��A | ��A | ��A | ��A | ��A | ��A | 0 |
| 2 | �� | �� | �� | |||||
| 3 | �� | �� | �� | �� | ||||
| 4 | �� | �� | �� |
��2���� �١���Ԫ�ص�����������ˮ��������Ե���Al��OH��3�����γɵ�����������ˮ����ķ���ʽ��HClO4��
��3�����γɵ���̬�⻯��Ľṹʽ��
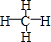 ��������ԭ�Ӳ�ȡsp3�ӻ����ռ乹��Ϊ�������壮
��������ԭ�Ӳ�ȡsp3�ӻ����ռ乹��Ϊ�������壮 ��̽��Ũ������ͭ��Ӧʱ��Ԫ������Ԫ�ص�������ǿ����
ʵ��װ����ͼ1��ʾ�����̶�װ������ȥ��
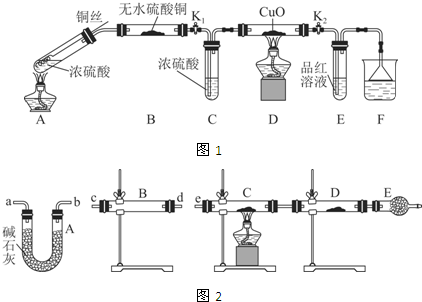
��1��A�з�Ӧ�Ļ�ѧ����ʽΪ2H2SO4��Ũ��+Cu$\frac{\underline{\;\;��\;\;}}{\;}$SO2��+SO42-+Cu2++2H2O��
��2��F�ձ��е���Һͨ����NaOH��Һ��������KMnO4��Һ�ȣ���
��3��ʵ������У���֤��Ũ��������Ԫ�ص�������ǿ����Ԫ�ص�������Dװ���к�ɫ������ɫ�ޱ仯��E����Һ��ɫ��
��4��ʵ�������֤��Aװ���Թ��з�Ӧ���ò����Ƿ���ͭ���ӵIJ��������ǽ�Aװ�����Թ�����ȴ�Ļ�����ر��ڣ�����������������ʢ��ˮ���ձ��У������Ͻ��裬����Һ�Ƿ������
���о�������п��Ũ���ᷴӦ���������壺
��1��������п��Ũ���ᷴӦ��ȡ�Ķ������������п��ܺ��е�������������ˮ������
��2��ijͬѧ������װ�ã���ͼ2�����ӳ�һ����ʵ��װ������֤��2�����ж��Ƿ���ȷ�������������������ʱ�����������ĸ�װ�õ��ܵı��������cd����dc��ab����ba��e����a��b����д����
��3�����ݣ�3��ȷ����ʵ����̣��뽫ʵ��ʱ�й�װ������ʢҩƷ��ʵ�������ۻ�����������к����ϣ�
| װ�� | ��ʢҩƷ | ʵ������ | ���ۻ���� |
| B | �� | �� | �� |
| C | CuO���� | �� | �� |
 ������Һ��ʯ��������Ҫ�ɷ֣���ȼ��ʱ�ܷų��������ȣ���Ϊ��Դ�㷺Ӧ�����������ճ������У�
������Һ��ʯ��������Ҫ�ɷ֣���ȼ��ʱ�ܷų��������ȣ���Ϊ��Դ�㷺Ӧ�����������ճ������У���1����֪����2C3H8��g��+7O2��g���T6CO��g��+8H2O��l����H=-2 741.8kJ•mol-1
��2CO��g��+O2��g���T2CO2��g����H=-566kJ•mol-1
��ӦC3H8��g��+5O2��g���T3CO2��g��+4H2O��l���ġ�H=-2219.9 kJ•mol-1��
��2��ij����С��Ϊ��̽������ͬ�¶��·�Ӧ�����������仯�뻯ѧƽ��Ĺ�ϵ����C3H8����ȫȼ�յIJ���CO��H2O��g����ͨ�뵽�����Ϊ1L��A��B�����ܱ������У�����ͬ�¶��¾��������¿��淴Ӧ��
CO��g��+H2O��g���TCO2��g��+H2��g����H=-41kJ•mol-1
����������£�
| ���� ��� | ��ʼʱ������ �����ʵ���/mol | �ﵽƽ�� ��ʱ��/min | �ﵽƽ��ʱ ��ϵ������ �仯/kJ | |||
| CO | H2O | CO2 | H2 | |||
| A | 1.5 | 1.9 | 0 | 0 | ta | �ų�������36.9 |
| B | 3 | 3.8 | 0 | 0 | tb | �ų�������Q |
��0��taʱ�̣�����A��CO��ƽ����Ӧ����Ϊ$\frac{0.9}{{t}_{a}}$ mol•L-1•min-1����ѧƽ�ⳣ��Ka=1.35��������B�з�Ӧ��ƽ�ⳣ��ΪKb������¶���Ka���ڣ�����ڡ���С�ڡ����ڡ���Kb��
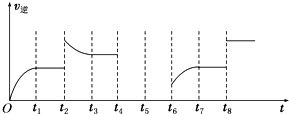
��ijͬѧΪ���о���Ӧ�����Ի�ѧƽ���Ӱ�죬����淴Ӧ������ʱ��Ĺ�ϵ��ͼ��ʾ��ͨ���о�ͼ���֣���Ӧ��t1��t3��t7ʱ���ﵽ��ƽ�⣬��t2��t8ʱ���ı���һ�����������Ǹı�������ֱ���t2�����¶ȣ�������CO2��Ũ�Ȼ�����H2��Ũ�ȣ���t8ʹ�ô������ѹ����С�������������
�۲��������A�з�Ӧ���е�t minʱ�����������CO2�����ʵ���Ϊ0.3mol������150mL 3mol•L-1��NaOH��Һ������ȫ���գ���������Һ������Ũ���ɴ�С��˳��Ϊc��Na+����c��HCO3-����c��CO32-����c��OH-����c��H+����
��3��CO2����ˮ����H2CO3����֪�������£�H2CO3��HClO�ĵ��볣�����£�
H2CO3?H++HCO${\;}_{3}^{-}$ Ka1=4.2��10-7 mol•L-1
HCO${\;}_{3}^{-}$?H++CO${\;}_{3}^{2-}$��Ka2=5.6��10-11 mol•L-1
HClO?H++ClO-��Ka=4.7��10-8 mol•L-1
��д��������̼���������ʵ���֮��Ϊ1��1ʱ������Ӧ�����ӷ���ʽ��Cl2+CO32-+H2O�TCl-+HClO+HCO3-��
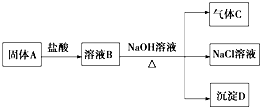
 ��ѧ��ͭ��Һ�к���һ������CuS04�������ŷŻ���Ⱦ���������õ绯ѧԭ���ɶԷ�Һ���л��մ�����װ����ͼ���������ӽ���Ĥֻ����H+ͨ����
��ѧ��ͭ��Һ�к���һ������CuS04�������ŷŻ���Ⱦ���������õ绯ѧԭ���ɶԷ�Һ���л��մ�����װ����ͼ���������ӽ���Ĥֻ����H+ͨ������֪����Cu2++HCHO+30H-=Cu+HCOO-+2H20��
�ڻ�ԭ�ԣ�HCHO��M��һ�ֽ�������Cu��
����˵����ȷ���ǣ�������
| A�� | ��Ӧ֮ǰ��Ӧ����OH-��HCHO��Һ���˵�װ�õ���� | |
| B�� | �Ҳ���ĵ缫��Ӧʽ��HCH0-2e-+H20=HC0O-+3H+ | |
| C�� | �������ӽ���Ĥ���������ӽ���Ĥ���ŵ�����У�������OH-�������Ǩ�� | |
| D�� | �ŵ�һ��ʱ�����أ���ȥ���ӽ���Ĥ��װ���п��ܻ��к�ɫ���塢��ɫ��״����� |
| A�� | 1��2 | B�� | 2��3 | C�� | 3��6 | D�� | 4��6 |
| A�� | �ø���ྻ�IJ�����պȡNaClO��Һ���ε����ڱ������ϵ�pH��ֽ�ϲ�pH | |
| B�� | ʵ��ʱ���帯ʴ���ˣ����ñ������ϴ�˿ڣ�����ˮϴ | |
| C�� | �����ؽᾧ���ᴿ������NaCl��KNO3���� | |
| D�� | ����ƿ���ζ����϶�����ʹ���¶ȣ�����ƿ�ޡ�O���̶ȣ��ζ����С�O���̶ȣ�ʹ��ǰˮϴ��ζ��ܻ�����ϴ��������ƿ����Ҫ��ϴ |
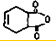 һ���������������������Ҫԭ�ϣ���ϳ�·�����£�
һ���������������������Ҫԭ�ϣ���ϳ�·�����£�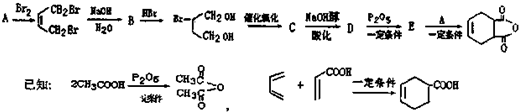
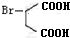 ��A��ϵͳ����Ϊ1��3-����ϩ��
��A��ϵͳ����Ϊ1��3-����ϩ�� ��
��