题目内容
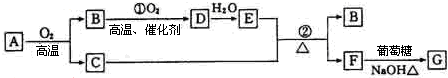
4.图l表示“侯氏制碱法”工业流程,图2表示各物质的溶解度曲线.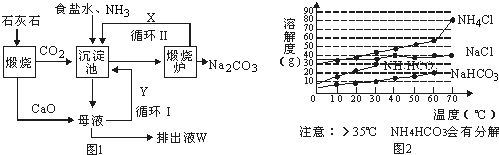
回答下列问题:
(1)图中X的化学式为CO2.
(2)沉淀池中发生反应的化学方程式为NaCl+H2O+NH3+CO2=NaHCO3↓+NH4Cl,该反应先向饱和食盐水中通入NH3(填化学式)至饱和,再通入另一种气体,若顺序颠倒,后果是不能析出NaHCO3晶体.
(3)沉淀池的反应温度控制在30~35℃,原因是NaHCO3溶解度小,低于300C反应速率慢,高于350CNaHCO3分解,不利于NaHCO3晶体析出.
(4)母液中加入CaO后生成Y的化学方程式为CaO+2NH4Cl=CaCl2+2NH3↑+H2O.
(5)氯碱工业是指电解饱和食盐水,这里的碱是指NaOH(填化学式),其另外两种气体产物可以用于工业上制取纯硅,流程如图3:
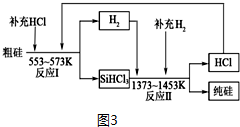
①整个制备过程必须严格控制无水无氧.SiHCl3遇水剧烈反应,写出该反应的化学方程式SiHCl3+3H2O═H2SiO3+3HCl+H2↑.
②假设每一轮次制备1mol纯硅,且生产过程中硅元素没有损失,反应I中HCl的利用率为90%,反应II中H2的利用率为93.75%.则在第二轮次的生产中,补充投入HCl 和H2的物质的量之比是5:1.
分析 侯氏制碱法制取纯碱反应原理可用下列化学方程式表示:NaCl(饱和)+NH3+CO2+H2O=NaHCO3↓+NH4Cl,2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O根据反应原理,饱和食盐水中通入氨气和二氧化碳析出碳酸氢钠晶体,再加热碳酸氢钠晶体就可以得到纯碱.
(1)根据碳酸氢钠煅烧的产物考虑;
(2)饱和食盐水中通入氨气和二氧化碳析出碳酸氢钠晶体,制取碳酸氢钠时先要得到含氨的饱和食盐水,所以应先通入氨气,氨气极易溶解于水,能形成较大浓度的溶液,有利于二氧化碳吸收,生成更多的碳酸氢铵,;
(3)根据题中所给信息“35℃NH4HCO3会有分解”分析解答,根据影响反应速率的因素分析,要控制恒温;
(4)母液中含有氯化铵,加入石灰乳后可以生成氨气;
(5)电解饱和氯化钠溶液,能生成氢氧化钠、氯气和氢气;
①写出反应物和给出的生成物H2SiO3和HCl,用原子守恒法找出另一种生成物为H2,并配平;
②反应生产1mol纯硅需补充HCl:$\frac{3}{90%}$-3,需补充H2:$\frac{1}{93.95%}$-1.
解答 解:(1)碳酸氢钠煅烧生成碳酸钠、水、二氧化碳,所以X是二氧化碳(CO2),故答案为:CO2;
(2)氨气、二氧化碳、水和氯化钠发生反应生成碳酸氢钠和氯化铵,反应方程式为NH3+H2O+CO2+NaCl═NH4Cl+NaHCO3↓,制取碳酸氢钠时先要得到含氨的饱和食盐水,所以应先通入氨气,氨气极易溶解于水,能形成较大浓度的溶液,有利于二氧化碳吸收,生成更多的碳酸氢铵,否则不能析出NaHCO3晶体,故答案为:NH3+H2O+CO2+NaCl═NH4Cl+NaHCO3,不能析出NaHCO3晶体;
(3)根据题意“35℃NH4HCO3会有分解”,所以温度不能超过35℃;同时反应速度受温度影响,温度太低反应速率太慢,所以温度必须控制在一个合理范围内,使温度保持一个恒定,故答案为:NaHCO3溶解度小,低于300C反应速率慢,高于350C NaHCO3分解,不利于NaHCO3晶体析出;
(4)过滤后得到的母液中含有氯化铵,母液中加入石灰乳后,反应生成氨气,方程式为:CaO+2NH4Cl=CaCl2+2NH3↑+H2O,故答案为:CaO+2NH4Cl=CaCl2+2NH3↑+H2O;
(5)电解饱和氯化钠溶液的方程式为:2NaCl+2H2O$\frac{\underline{\;通电\;}}{\;}$2NaOH+H2↑+Cl2↑,碱是指NaOH,故答案为:NaOH;
①SiHCl3遇水剧烈反应生成H2SiO3、HCl和氢气:SiHCl3+3H2O═H2SiO3↓+H2↑+3HCl↑,故答案为:SiHCl3+3H2O═H2SiO3↓+3HCl↑+H2↑;
②反应生产1mol纯硅需补充HCl:$\frac{3}{90%}$-3,需补充H2:$\frac{1}{93.95%}$-1,补充HCl与H2的物质的量之比为≈5:1,故答案为:5:1.
点评 本题主要考查了学生运用溶解度有关知识分析解决纯碱制取过程中有关问题.联合制碱法的原料、反应式以及副产物的回收利用,还考查硅及其化合物的性质,涉及化学方程式的书写、以及根据方程式的计算,计算是该题的难点.

| A. | 明矾溶液具有酸性,可用于清除铜镜表面的铜锈 | |
| B. | 晶体硅熔点高、硬度大,可用于制作半导体材料 | |
| C. | 氨气能使酚酞试液变红,可用于设计喷泉实验 | |
| D. | 氧化铁能与酸反应,可用于制作红色颜料 |
| A. | 若混合气体的密度不再改变时,该反应不一定达到平衡状态 | |
| B. | 2min后,加压会使正反应速率增大,逆反应速率减小,平衡正向移动 | |
| C. | 反应过程中A和B的转化率之比为3:1 | |
| D. | 该条件下此反应的化学平衡常数的数值约为0.91 |
③酸性KMnO4溶液可将NO2-氧化为NO3-,MnO4-还原成Mn2+.
Ⅰ.产品制备与检验:用如图1装置制备NaNO2:
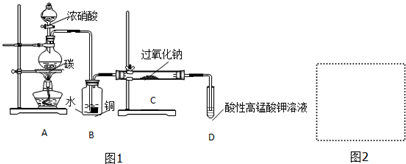
(1)写出装置A烧瓶中发生反应的化学方程式并标出电子转移的方向和数目

(2)B装置的作用是将NO2转化为NO,同时Cu与稀硝酸反应生成NO(或制取NO)
(3)有同学认为装置C中产物不仅有亚硝酸钠,还有硝酸钠、碳酸钠、氢氧化钠,为制备纯净NaNO2应在B、C装置间增加一个装置,请在右框内画出增加的装置图2,并标明盛放的试剂.
(4)试设计实验检验装置C中NaNO2的存在(写出操作、现象和结论)取少量装置C中产物置于试管中,加入适量蒸馏水溶解,(加入稀硫酸酸化)滴加入1-2滴(少量)酸性KMnO4溶液,若溶液紫色褪去,说明C中产物含有NaNO2
Ⅱ.含量的测定
称取装置C中反应后的固体4.00g溶于水配成250mL溶液,取25.00mL溶液于锥形瓶中,用0.1000mol/L酸性KMnO4溶液进行滴定,实验所得数据如下表所示:
| 滴定次数 | 1 | 2 | 3 | 4 |
| KMnO4溶液体积/mL | 20.60 | 20.02 | 20.00 | 19.98 |
A.酸式滴定管用蒸馏水洗净后未用标准液润洗 B.锥形瓶洗净后未干燥
C.滴定结束仰视读数 D.滴定结束俯视读数
(6)根据表中数据,计算所得固体中亚硝酸钠的质量分数86.25%或0.8625(结果保留4位有效数字)
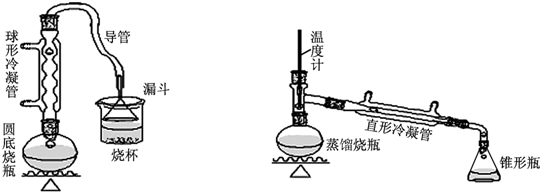
请回答下列问题:
(1)A装置中,在烧杯里的液面倒扣一个漏斗,其目的是既可以吸收充分,又可以防止倒吸.
(2)制备操作中,加入的浓硫酸事先必须进行稀释,其目的是ab.(填字母)
a.减少副产物烯和醚的生成 b.减少Br2的生成 c.水是反应的催化剂
(3)有同学拟通过红外光谱仪鉴定所得产物中是否含有“-CH2CH2CH2CH3”,来确定副产物中是否存在丁醚(CH3CH2CH2CH2OCH2CH2CH2CH3).请评价该同学设计的鉴定方案是否合理?为什么?
(4)为了进一步提纯1-溴丁烷,该小组同学查得相关有机物的有关数据如表:
| 物质 | 熔点/℃ | 沸点/℃ |
| 1-丁醇 | -89.5 | 117.3 |
| 1-溴丁烷 | -112.4 | 101.6 |
| 丁醚 | -95.3 | 142.4 |
| 1-丁烯 | -185.3 | -6.5 |
 铁是日常生活中用途最广、用量最大的金属材料.
铁是日常生活中用途最广、用量最大的金属材料.