题目内容
在一定温度下冰醋酸加水稀释的过程中,溶液的导电能力如图3-2所示,请完成下列问题: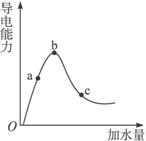
图3-2
(1)“O”点导电能力为零的理由是__________。
(2)a、b、c三点处,溶液的c(H+)由大到小的顺序为___________________。
(3)a、b、c三点处,电离程度最大的是_____________________。
(4)若使c点溶液中c(CH3COO-)增大,c(H+)减小,可采取的措施为:
①________。②________。
③________。④_________。
解析:在冰醋酸中加水,醋酸被稀释,其电离程度增大,但影响c(H+)的因素有两个,其一是醋酸电离程度增大,c(H+)要增大;其二是溶液体积增大,c(H+)要减小。图中b之前前者起主要作用,b之后后者起主要作用,则c(H+):b>a>c。
答案:(1)醋酸是共价化合物,冰醋酸中无水,不能电离,体系中无自由移动的离子,导电能力几乎为零
(2)b>a>c (3)c
(4)①加较活泼金属,如Zn、Mg等 ②加碱、如NaOH固体 ③加CH3COONa固体 ④加酸性较醋酸弱的弱酸盐,如Na2S、NaHCO3固体

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
 在一定温度下,冰醋酸加水稀释过程中溶液的导电能力如图所示,请回答:
在一定温度下,冰醋酸加水稀释过程中溶液的导电能力如图所示,请回答: 在一定温度下,冰醋酸加水稀释过程中,溶液的导电能力如图所示.下列说法不正确的是( )
在一定温度下,冰醋酸加水稀释过程中,溶液的导电能力如图所示.下列说法不正确的是( )