题目内容
【题目】SO2、NO是大气污染物,NH4NO3、H2SO4等是水体污染物,有效去除这些污染物是一项重要课题。
(1)NO、SO2可以先氧化,后用碱吸收。其氧化过程的反应原理如下:
NO(g)+O3(g)NO2(g)+O2(g) H1=-200.9kJ/mol
SO2(g)+O3(g) SO3(g)+O2(g) H2=-241.6kJ/mol
2SO2(g)+O2(g) 2SO3(g) H3=-196.6kJ/mol
则反应2NO2(g) 2NO(g)+O2(g)的H=___kJ/mol
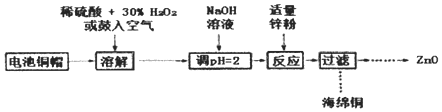
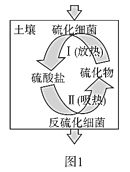
(2)土壤中的硫循环如图1所示。
①土壤中的黄铁矿(FeS2)在过程I中会转化成硫酸亚铁和硫酸。该过程发生反应的化学方程式为_____;
②某种反硫化细菌在过程II中需要有乳酸参与反应消耗硫酸生成H2S并伴有热量放出,那么乳酸除在反应中作还原剂外,还存在另一作用,请解释原因:_____;
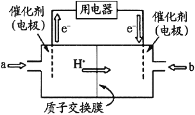
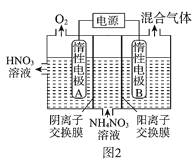
(3)电解法除去工业废水中的硝酸铵的装置示意图如图2所示,阴极电极反应式为____;
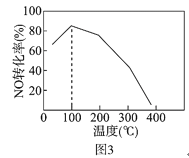
(4)向恒容密闭容器中充入1molNO和2molO3,发生如下反应:NO(g)+O3(g) NO2(g)+O2(g) △H<0不同温度下反应相同时间后,体系中NO转化率随温度变化曲线如图3。温度低于100℃时,NO转化率随温度升高而增大的主要原因是_____;当温度高于100℃时,NO转化率随温度升高而降低,原因是_____。
【答案】+115.2 2FeS2+7O2+2H2O=2FeSO4+2H2SO4 因为过程II(反硫化过程)吸热,乳酸和硫酸反应放出的热量使温度升高促进了过程II(反硫化过程)的进行;[或:因为过程II(反硫化过程)吸热,需要反硫化细菌提供能量(ATP),而乳酸和硫酸反应放出热量提供给反硫化细菌(以ATP形式),使过程II(反硫化过程)进行] 2NH4++2e-=2NH3↑+H2↑ 低于100℃时,相同时间内反应未达到平衡状态。温度升高,化学反应速率加快,NO即时转化率高 100℃时,在相同时间内,反应达到平衡,由于该反应是放热反应,温度升高平衡左移,NO平衡转化率降低
【解析】
(1)根据盖斯定律计算(②-①)×2得到反应2NO2(g)2NO(g)+O2(g)的△H;
(2)①土壤中的黄铁矿(FeS2)在过程Ⅰ中和氧气、水反应会转化成硫酸亚铁和硫酸;
②某种反硫化细菌在过程Ⅱ中需要有乳酸参与反应消耗硫酸,生成H2S并伴有热量放出,那么乳酸除在反应中作还原剂外,乳酸和硝酸反应放出的热量使温度升高促进了过程Ⅱ的进行;
(3)装置图中放出氧气的为阳极,溶液中铵根离子在阴极得到电子生成混合气体为氨气和氢气;
(4)温度低于100℃时,NO转化率随温度升高而增大是反应为达到平衡状态,反应正向进行,已知温度高时,O3分解生成活性极高的氧原子,NO转化率随温度升高而降低,由于反应为放热反应,随温度升高平衡逆向进行,同时发生反应NO2+O=NO+O2使转化率降低。
(1)已知:①NO(g)+O3(g)NO2(g)+O2(g)△H1=200.9kJmol1
②SO2(g)+O3(g)SO3(g)+O2(g)△H2=241.6kJmol1
③2SO2(g)+O2(g)2SO3(g)△H3=196.6kJmol1
盖斯定律计算(②-①)×2得到反应2NO2(g)2NO(g)+O2(g)的△H=+115.2kJ/mol;
(2)①土壤中的黄铁矿(FeS2)在过程Ⅰ中和氧气、水反应会转化成硫酸亚铁和硫酸,反应的化学方程式:2FeS2+7O2+2H2O=2FeSO4+2H2SO4;
②土壤中的黄铁矿(FeS2)在过程Ⅰ中和氧气、水反应会转化成硫酸亚铁和硫酸;某种反硫化细菌在过程Ⅱ中需要有乳酸参与反应消耗硫酸,生成H2S并伴有热量放出,那么乳酸除在反应中作还原剂外,乳酸和硝酸反应放出的热量使温度升高促进了过程Ⅱ的进行[或:因为过程II(反硫化过程)吸热,需要反硫化细菌提供能量(ATP),而乳酸和硫酸反应放出热量提供给反硫化细菌(以ATP形式),使过程II(反硫化过程)进行];
(3)电解法除去工业废水中的硝酸铵是铵根离子得到电子生成氨气和氢气,电极反应:2NH4++2e=2NH3↑+H2↑;
(4)温度低于100℃时,NO转化率随温度升高而增大的主要原因是:低于100℃,反应速率慢相同时间内还没有达到平衡状态,已知温度高时,O3分解生成活性极高的氧原子,NO转化率随温度升高而降低,可能的原因有:温度高时反应速率快,相同时间内已经达到平衡状态,由于反应为放热反应,随温度升高平衡逆向进行,同时发生反应NO2+O=NO+O2使转化率降低。

 考前必练系列答案
考前必练系列答案【题目】实验室制备溴苯的反应装置如图所示,回答下列问题:
已知:
苯 | 溴 | 溴苯 | |
密度/g·cm-3 | 0.88 | 3.10 | 1.50 |
水中的溶解度 | 微溶 | 微溶 | 微溶 |

(1)实验装置c的作用为_______。
(2)写出实验室制备溴苯的反应方程式_______。
(3)本实验得到粗溴苯后,除去铁屑,再用如下操作精制:a蒸馏;b水洗;c用干燥剂干燥;d 10%NaOH溶液洗涤;e水洗,正确的操作顺序是________。
(4)本实验使用6mL无水苯、4.0mL液溴和少量铁屑,充分反应,经精制得到6.5mL的溴苯。则该实验中溴苯的产率是_______。