题目内容
19.在下列溶液中,各组离子一定能够大量共存的是( )| A. | 使酚酞试液变红的溶液:Na+、Cl-、SO${\;}_{4}^{2-}$、Fe3+ | |
| B. | 常温下$\frac{{K}_{w}}{c({H}^{+})}$=0.1mol•L-1的溶液:K+、Na+、SiO${\;}_{3}^{2-}$、NO${\;}_{3}^{-}$ | |
| C. | 使紫色石蕊试液变红的溶液:Fe2+、Mg2+、MnO${\;}_{4}^{-}$、Cl- | |
| D. | 澄清透明溶液:Al3+、Na+、SO${\;}_{4}^{2-}$、HCO3- |
分析 A.使酚酞试液变红的溶液,显碱性;
B.常温下$\frac{{K}_{w}}{c({H}^{+})}$=0.1mol•L-1的溶液,显碱性;
C.使紫色石蕊试液变红的溶液,显酸性;
D.离子之间相互促进水解.
解答 解:A.使酚酞试液变红的溶液,显碱性,不能大量存在Fe3+,故A不选;
B.常温下$\frac{{K}_{w}}{c({H}^{+})}$=0.1mol•L-1的溶液,显碱性,该组离子之间不反应,可大量共存,故B选;
C.使紫色石蕊试液变红的溶液,显酸性,Fe2+、H+、MnO4-发生氧化还原反应,不能共存,故C不选;
D.Al3+、HCO3-相互促进水解,不能共存,故D不选;
故选B.
点评 本题考查离子的共存,为高频考点,把握习题中的信息及常见离子之间的反应为解答的关键,侧重分析与应用能力的考查,注意复分解反应、氧化还原反应、水解反应的判断,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
10.毒重石的主要成分BaCO3(含Ca2+、Mg2+、Fe3+等杂质),实验室利用毒重石制备BaCl2•2H2O的流程如图:

已知:Ksp(BaC2O4)=1.6×10-7,Ksp(CaC2O4)=2.3×10-9
(1)实验室用37%的盐酸配制1mol/L盐酸,下列仪器中,不需要使用的是d
a.容量瓶 b.量筒 c.烧杯 d.滴定管
为了加快毒重石的酸浸速率,可以采取的措施有研磨成粉、加热、搅拌等(至少两条).
(2)加入氨水调节溶液pH=8的目的是使Fe3+形成Fe(OH)3沉淀而除去.滤渣Ⅱ中含Mg(OH)2、Ca(OH)2(填化学式).加入H2C2O4时应避免过量,原因是H2C2O4过量会导致形成BaC2O4沉淀,产品产量减少.
(3)操作Ⅳ的步骤是:蒸发浓缩、冷却结晶、过滤.
(4)利用间接酸碱滴定法可测定Ba2+的含量,实验分两步进行.
已知:2CrO42-+2H+=Cr2O72-+H2O;Ba2++CrO42-=BaCrO4↓
步骤Ⅰ:移取x mL一定浓度的Na2CrO4溶液于锥形瓶中,加入酸碱指示剂,用b mol•L-1盐酸标准液滴定至终点,测得滴加盐酸体积为V0mL.
步骤Ⅱ:移取y mL BaCl2溶液于锥形瓶中,加入x mL与步骤Ⅰ相同浓度的Na2CrO4溶液,待Ba2+完全沉淀后,再加入酸碱指示剂,用b mol•L-1盐酸标准液滴定至终点,测得滴加盐酸的体积为V1mL.通过计算,氯化钡溶液浓度为$\frac{(V{\;}_{0}-{V}_{1})b}{y}$ mol•L-1(用含字母的式子表示).

| Ca2+ | Mg2+ | Fe3+ | |
| 开始沉淀的pH | 11.9 | 9.1 | 1.9 |
| 完全沉淀的pH | 13.9 | 11.1 | 3.2 |
(1)实验室用37%的盐酸配制1mol/L盐酸,下列仪器中,不需要使用的是d
a.容量瓶 b.量筒 c.烧杯 d.滴定管
为了加快毒重石的酸浸速率,可以采取的措施有研磨成粉、加热、搅拌等(至少两条).
(2)加入氨水调节溶液pH=8的目的是使Fe3+形成Fe(OH)3沉淀而除去.滤渣Ⅱ中含Mg(OH)2、Ca(OH)2(填化学式).加入H2C2O4时应避免过量,原因是H2C2O4过量会导致形成BaC2O4沉淀,产品产量减少.
(3)操作Ⅳ的步骤是:蒸发浓缩、冷却结晶、过滤.
(4)利用间接酸碱滴定法可测定Ba2+的含量,实验分两步进行.
已知:2CrO42-+2H+=Cr2O72-+H2O;Ba2++CrO42-=BaCrO4↓
步骤Ⅰ:移取x mL一定浓度的Na2CrO4溶液于锥形瓶中,加入酸碱指示剂,用b mol•L-1盐酸标准液滴定至终点,测得滴加盐酸体积为V0mL.
步骤Ⅱ:移取y mL BaCl2溶液于锥形瓶中,加入x mL与步骤Ⅰ相同浓度的Na2CrO4溶液,待Ba2+完全沉淀后,再加入酸碱指示剂,用b mol•L-1盐酸标准液滴定至终点,测得滴加盐酸的体积为V1mL.通过计算,氯化钡溶液浓度为$\frac{(V{\;}_{0}-{V}_{1})b}{y}$ mol•L-1(用含字母的式子表示).
7.下列说法正确的是( )
| A. | 0.1 mol•L-1的硫酸铵溶液中:c(NH4+)>c(SO42-)>c(H+)=c(OH-) | |
| B. | 常温下等体积pH相同的CH3COOH和HCl溶液,消耗NaOH的量一样多 | |
| C. | 常温下,醋酸钠与醋酸的混合溶液pH=7:则c(Na+)>c(CH3COO-) | |
| D. | 0.1mol•L-1NaHCO3溶液中:c(Na+)+c(H+)=c(HCO3-)+2 c(CO32-)+c(OH-) |
14.已知700C时纯水KW=1×10-12,下列叙述正确的是( )
| A. | 700C时,向纯水中加人H3PO4后,水的Kw减小 | |
| B. | 700C的Na2CO3溶液中c(Na+)>c(CO32-)c(HCO3-)>c(OH-)>c(H+) | |
| C. | 700C的H2S04溶液中c(H+)=c(OH-)+2c(SO42-) | |
| D. | 将室温下0.1 mol/L的NaOH溶液加热至700C时,c(OH-)/c(H+)随之增大 |
4.常温下,下列各组离子在指定溶液中一定能大量共存的是( )
| A. | pH=1的溶液中:K+、Fe2+、NO${\;}_{3}^{-}$、Cl- | |
| B. | 0.1 mol•L-1NaHCO3溶液:Na+、Ba2+、NO${\;}_{3}^{-}$、OH- | |
| C. | 滴加KSCN溶液显红色的溶液:NH${\;}_{4}^{+}$、K+、Cl-、I- | |
| D. | 澄清透明的溶液中:Cu2+、K+、SO${\;}_{4}^{2-}$、Cl- |
11.硫酸钙可用于生产硫酸、漂白粉等一系列物质(见图).下列说法正确的是( )
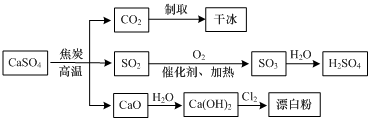

| A. | CO2制取干冰的过程吸收热量,属于物理变化 | |
| B. | 硫酸钙与焦炭反应时生成的n(CO2):n(SO2)=1:2 | |
| C. | 由SO2制取H2SO4的过程均为氧化还原反应 | |
| D. | 石灰乳与Cl2反应制取漂白粉时,Cl2仅作还原剂 |
8.用NA为阿伏加德罗常数的值,下列叙述中正确的是( )
| A. | 25℃时,pH=13的1.0LBa(OH)2溶液中含有的OH-数目为0.1NA | |
| B. | 标准状况下,2.24L乙烷含有的化学键总数为0.8NA | |
| C. | 常温下,23gNO2和N2O4的混合气体中含有的氮原子数为0.5 NA | |
| D. | 标准状况下,22.4L甲醇中含有的氧原子数为NA |
1.铁及其化合物在日常生活、生产中应用广泛.
(1)高铁酸钠(Na2FeO4)是水处理过程中的一种新型净水剂,它的氧化性比高锰酸钾更强,本身在反应中被还原成三价铁离子达到净水的目的.按要求回答下列问题:
高铁酸钠主要通过如下反应制取:2Fe(OH)3+3NaClO+4NaOH═2Na2FeO4+3X+5H2O,则X的化学式NaCl,反应中Fe被氧化.
(2)氧化铁红颜料跟某些油料混合,可以制成防锈油漆.以黄铁矿为原料制硫酸产生的硫酸渣中含Fe2O3、SiO2、Al2O3、MgO等,用硫酸渣制备铁红(Fe2O3)的过程如图:
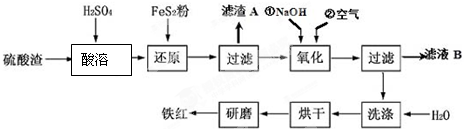
①酸溶过程中Fe2O3与稀硫酸反应的化学方程式为Fe2O3+3H2SO4═Fe2(SO4)3+3H2O;
“滤渣A”主要成份的化学式为SiO2.
②还原过程中加入FeS2的目的是将溶液中的Fe3+还原为Fe2+,而本身被氧化为H2SO4,请完成该反应的离子方程式:FeS2+14Fe3++8H2O═15Fe2++2SO42-+16H+.
③氧化过程中,O2、NaOH与Fe2+反应的离子方程式为4Fe2++O2+2H2O+8OH-=4Fe(OH)3↓.
④为了确保铁红的质量和纯度,氧化过程需要调节溶液的pH的范围是3.2~3.8,如果pH过大,可能引起的后果是Al3+、Mg2+形成沉淀,使制得的铁红不纯(几种离子沉淀的pH见表);滤液B可以回收的物质有(写化学式)Na2SO4、Al2(SO4)3、MgSO4.
(1)高铁酸钠(Na2FeO4)是水处理过程中的一种新型净水剂,它的氧化性比高锰酸钾更强,本身在反应中被还原成三价铁离子达到净水的目的.按要求回答下列问题:
高铁酸钠主要通过如下反应制取:2Fe(OH)3+3NaClO+4NaOH═2Na2FeO4+3X+5H2O,则X的化学式NaCl,反应中Fe被氧化.
(2)氧化铁红颜料跟某些油料混合,可以制成防锈油漆.以黄铁矿为原料制硫酸产生的硫酸渣中含Fe2O3、SiO2、Al2O3、MgO等,用硫酸渣制备铁红(Fe2O3)的过程如图:

①酸溶过程中Fe2O3与稀硫酸反应的化学方程式为Fe2O3+3H2SO4═Fe2(SO4)3+3H2O;
“滤渣A”主要成份的化学式为SiO2.
②还原过程中加入FeS2的目的是将溶液中的Fe3+还原为Fe2+,而本身被氧化为H2SO4,请完成该反应的离子方程式:FeS2+14Fe3++8H2O═15Fe2++2SO42-+16H+.
③氧化过程中,O2、NaOH与Fe2+反应的离子方程式为4Fe2++O2+2H2O+8OH-=4Fe(OH)3↓.
| 沉淀物 | Fe(OH)3 | Al(OH)3 | Fe(OH)2 | Mg(OH)2 |
| 开始沉淀pH | 2.7 | 3.8 | 7.6 | 9.4 |
| 完全沉淀pH | 3.2 | 5.2 | 9.7 | 12.4 |
| 沉淀物 | Fe(OH)3 | Al(OH)3 | Fe(OH)3 | Mg(OH)2 |
| 开始沉淀Ph | 2.7 | 3.8 | 7.6 | 9.4 |
| 完全沉淀pH | 3.2 | 5.2 | 9.7 | 12.4 |
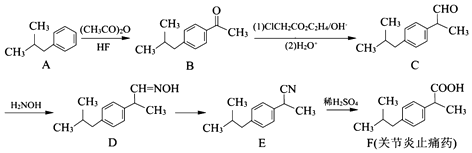
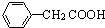 (任写一种);X有多种同分异构体,满足下列条件的X的同分异构体共有3种.
(任写一种);X有多种同分异构体,满足下列条件的X的同分异构体共有3种. .
. $→_{AlCl_{3}}^{RCl}$
$→_{AlCl_{3}}^{RCl}$

 $\stackrel{CO、Pd}{→}$
$\stackrel{CO、Pd}{→}$ R、R′表示烃基
R、R′表示烃基 、苯、(CH3CO)2O为原料来合成,写出有关的合成路线流程图(无机试剂任选).合成路线流程图示例如下:CH3CH2Br$→_{△}^{NaOH溶液}$CH3CHOH$→_{浓硫酸,△}^{CH_{3}COOH}$CH3COOCH2CH3.
、苯、(CH3CO)2O为原料来合成,写出有关的合成路线流程图(无机试剂任选).合成路线流程图示例如下:CH3CH2Br$→_{△}^{NaOH溶液}$CH3CHOH$→_{浓硫酸,△}^{CH_{3}COOH}$CH3COOCH2CH3.