题目内容
14.氨的水溶液显弱碱性,其原因是NH3•H2O?NH4++OH-(用离子方程式表示),0.1mol/L的氨水中加入少量NH4Cl固体,溶液的pH降低(填“升高”或“降低”);将等浓度等体积的氨水和氯化铵溶液混合,溶液中离子浓度从大到小的顺序为c (NH4+)>c(Cl-)>c(OH-)>c(H+).分析 氨的水溶液显弱碱性是一水合氨在水溶液中电离生成铵根离子和氢氧根离子,溶液显碱性,0.1mol/L的氨水中加入少量NH4Cl固体,溶解后铵根离子浓度增大抑制一水合氨电离氢氧根离子浓度减小,将等浓度等体积的氨水和氯化铵溶液混合,一水合氨电离程度大于铵根离子的水解程度溶液显碱性;
解答 解:氨的水溶液显弱碱性是一水合氨在水溶液中电离生成铵根离子和氢氧根离子,溶液显碱性,电离方程式为:NH3•H2O?NH4++OH-,0.1mol/L的氨水中加入少量NH4Cl固体,溶解后铵根离子浓度增大,抑制一水合氨电离氢氧根离子浓度减小,溶液PH减小,将等浓度等体积的氨水和氯化铵溶液混合,一水合氨电离程度大于铵根离子的水解程度溶液显碱性,溶液中离子浓度大小为:c (NH4+)>c(Cl-)>c(OH-)>c(H+),
故答案为:NH3•H2O?NH4++OH-; 降低;c (NH4+)>c(Cl-)>c(OH-)>c(H+).
点评 本题考查了弱电解质电离平衡和影响因素、盐类水解原理、电解质溶液中离子浓度大小比较,掌握基础是解题关键,题目难度不大.

练习册系列答案
 名校联盟快乐课堂系列答案
名校联盟快乐课堂系列答案 黄冈创优卷系列答案
黄冈创优卷系列答案
相关题目
4.下列化学用语正确的是( )
| A. | 二氧化硅的分子式:SiO2 | B. | 甲基的电子式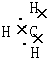 | ||
| C. | 水分子的结构式:H-O-H | D. | Na2O2中阴,阳离子数之比为1:1 |
5.氧化还原反应与四种基本类型反应的关系如下图所示,则下列化学反应属于区域3的是( )
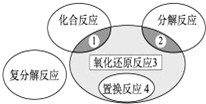

| A. | 2H2+O2$\frac{\underline{\;点燃\;}}{\;}$2H2O | B. | 2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+H2O+CO2↑ | ||
| C. | Zn+H2SO4═ZnSO4+H2↑ | D. | CuO+CO$\frac{\underline{\;\;△\;\;}}{\;}$Cu+CO2 |
19.某有机物的结构简式为 ,关于它的叙述中正确的是( )
,关于它的叙述中正确的是( )
 ,关于它的叙述中正确的是( )
,关于它的叙述中正确的是( )| A. | 1mol该有机物最多能够和2molNaOH发生反应 | |
| B. | 和乙醇发生酯化反应时,羧基中的-OH将被CH3CH2-取代 | |
| C. | 铜做催化剂并加热的条件下,羟基中的氢氧键会断裂 | |
| D. | 和  互为同分异构体 互为同分异构体 |
6.以下实验能获得成功的是( )
| A. | 苯和硝基苯直接采用分液的方法分离 | |
| B. | 将铁屑、溴水、苯混合制溴苯 | |
| C. | 在溴乙烷中加入NaOH水溶液共热,然后加入稀硝酸至呈酸性,再滴入AgNO3溶液,通过观察有无浅黄色沉淀来检验溴乙烷中的溴元素 | |
| D. | 在蔗糖溶液中加入稀硫酸共热,然后加入银氨溶液水浴加热,通过观察有无银镜生成来检验蔗糖的水解产物中有无还原性糖 |
3.一定条件下,溶液的酸碱性对TiO2光催化染料R降解反应的影响如图所示:下列判断正确的是( )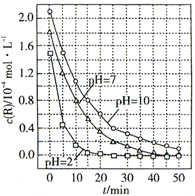

| A. | 溶液酸性越强,R的降解速率越小 | |
| B. | R的起始浓度越小,降解速率越大 | |
| C. | 在0~50 min之间,pH=2和pH=7时R的降解百分率相等 | |
| D. | 在20~25 min之间,pH=10时R的平均降解速率为0.02 mol•L-1•min-1 |
 .
. .
.