题目内容
5.化合物X是一种具有浓郁香味的有机物,X在酸性条件下水解得到A和B(A和B分子中含有相同的碳原子数).M是石油裂解的主要产品之一,M的气体密度是相同条件下H2的14倍,M在一定条件下与水反应得到A.请回答下列问题.(1)①M的结构简式为CH2=CH2;②B中所含有官能团名称是羧基.
(2)写出化合物X在稀硫酸条件下水解生成A和B的化学方程式:CH3COOC2H5+H2O$?_{△}^{浓硫酸}$CH3COOH+C2H5OH.
(3)A在一定条件下,经过2步可以合成B,试写出该两步反应的化学方程式,要求注明反应条件:2CH3CH2OH+O2$→_{△}^{Cu}$2CH3CHO+2H2O、2CH3CHO+O2$\stackrel{催化剂}{→}$2CH3COOH
(4)某有机物Y比A多2个碳原子,且与A物质互为同系物关系,1H核磁共振谱图显示有2条峰谱且面积之比为9:1,请写出Y的结构简式(CH3)3C-OH.
分析 M是石油裂解的主要产品之一,M的气体密度是相同条件下H2的14倍,则相对分子质量为28,应为CH2=CH2,在一定条件下与水反应得到A,则A为C2H5OH,化合物X是一种具有浓郁香味的有机物,X在酸性条件下水解得到A和B,可知X为酯类化合物,水解生成醇和酸,A和B分子中含有相同的碳原子数,则B为CH3COOH,X为CH3COOC2H5,以此解答该题.
解答 解:M是石油裂解的主要产品之一,M的气体密度是相同条件下H2的14倍,则相对分子质量为28,应为CH2=CH2,在一定条件下与水反应得到A,则A为C2H5OH,化合物X是一种具有浓郁香味的有机物,X在酸性条件下水解得到A和B,可知X为酯类化合物,水解生成醇和酸,A和B分子中含有相同的碳原子数,则B为CH3COOH,X为CH3COOC2H5,
(1)①由以上分析可知M为CH2=CH2,故答案为:CH2=CH2;
②B为CH3COOH,含有的官能团为-COOH,为羧基,故答案为:羧基;
(2)乙酸乙酯在酸性条件下水解生成乙酸和乙醇,方程式为CH3COOC2H5+H2O$?_{△}^{浓硫酸}$CH3COOH+C2H5OH,
故答案为:CH3COOC2H5+H2O$?_{△}^{浓硫酸}$CH3COOH+C2H5OH;
(3)A为乙醇,在催化条件下反应生成乙醛,乙醛与氧气进一步反应可生成乙酸,方程式为2CH3CH2OH+O2 $→_{△}^{Cu}$2CH3CHO+2H2O、2CH3CHO+O2 $\stackrel{催化剂}{→}$ 2CH3COOH,
故答案为:2CH3CH2OH+O2 $→_{△}^{Cu}$2CH3CHO+2H2O、2CH3CHO+O2 $\stackrel{催化剂}{→}$ 2CH3COOH;
(4)某有机物Y比乙烯多2个碳原子,且与乙烯物质互为同系物关系,1H核磁共振谱图显示有2条峰谱且面积之比为9:1,Y的结构简式应为(CH3)3C-OH,
故答案为:(CH3)3C-OH.
点评 本题考查有机物推断,为高考常见题型,侧重于学生的分析能力的考查,注意确定烯烃M是关键,再结合转化关系推断,注意官能团的性质与转化,难度不大.

 阅读快车系列答案
阅读快车系列答案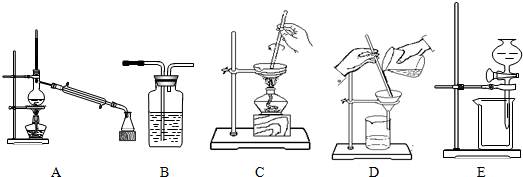
下表中的四项实验都需要进行分离操作,请从上述A~E中选择合适的分离操作,将序号填在表格中.
| 实验 | 所需分离操作 |
| 1.某活动小组用海水制取粗盐 | |
| 2.某活动小组从原油中分离出汽油、煤油等 | |
| 3.某活动小组将粗盐溶于水,除去其不溶的泥沙 | |
| 4.某活动小组用氢氧化钠溶液洗去CCl4中的I2 |
| 操 作 | 现 象 |
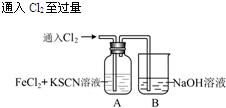 | I.A中溶液变红 Ⅱ.稍后,溶液由红色变为黄色 |
(2)A中溶液变红的原因是Fe2+被Cl2氧化生成Fe3+,Fe3+与SCN-反应生成红色的,所以溶液变红.
(3)为了探究现象II的原因,甲同学进行如下实验.
①取A中黄色溶液于试管中,加入NaOH溶液,有红褐色沉淀生成,则溶液中一定存在.
②取A中黄色溶液于试管中,加入过量的KSCN溶液,最终得到红色溶液.
甲同学的实验证明产生现象Ⅱ的原因是SCN-与Cl2发生了反应.
(4)甲同学猜想SCN-可能被Cl2氧化了,他又进行了如下研究.
资料显示:SCN-的电子式为
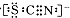
①甲同学认为SCN-中碳元素没有被氧化,理由是SCN-中的碳元素是最高价态+4价.
②取A中黄色溶液于试管中,加入用盐酸酸化的BaCl2溶液,产生白色沉淀,由此证明SCN-中被氧化的元素是硫元素.
③通过实验证明了SCN-中氮元素转化为NO3-.
④若SCN-与Cl2反应生成1mol CO2,则转移电子的物质的量是16mol.
I.探究草酸与髙锰酸钾溶液在不同条件下反应的快慢
取4支试管,分别加入0.10mol/L的草酸溶液5mL,按以下表中四种方案分别加人相 应的试剂,使其发生反应.四支试管中均可观察到有气泡产生,且溶液的颜色变化都 为:紫红色→红色→橙红色→橙色→黄色→无色,溶液褪为无色所需的时间如表所 示(表中“一”表示未加入该试剂).
| 实验 编号 | 反应温度 (利用水浴加热) | 稀硫酸 溶液 | MnSO4固体 | 0.10mol/L KMnO4溶液 | 褪色 时间 |
| 1 | 65℃ | ---- | --- | 1mL | 100s |
| 2 | 65℃ | 10滴 | --- | 1mL | 90s |
| 3 | 75℃ | 10滴 | ---- | 1mL | 40s |
| 4 | 75℃ | 10滴 | 加入少许 | 1mL | 3s |
II.测定草酸晶体的纯度
用托盘天平称取草酸晶体(H2C2O4•2H2O)W g;配制成250mL溶液;每次移取25.00mL该溶液于锥形瓶中,用0.10moI/L酸性高锰酸钾溶液滴定;滴定实验重复操 作2~3次.请回答:
(1)实验中需要用到的玻璃仪器除了玻璃棒、烧杯、锥形瓶、胶头滴管、250mL容量瓶 外还需要的一种玻璃仪器是酸式滴定管
(2)上述H2C2O4溶液与酸性KMnO4溶液反应的离子方程为5H2C2O4+2MnO4-+6H+=2Mn2++10CO2↑++8H2O.
(3)若滴定过程中平均消耗酸性髙锰酸钾溶液VmL,则草酸晶体的纯度为$\frac{31.5V}{W}%$(以含W、V的表达式表示).
| A. | 甲烷 | B. | 二氧化碳 | C. | 二氧化硫 | D. | 氢气 |
| A. | SiO2 | B. | KOH | C. | Na2O2 | D. | I2 |
 某化学学习小组发现在碱性溶液中,NO2会发生如下反应:
某化学学习小组发现在碱性溶液中,NO2会发生如下反应: