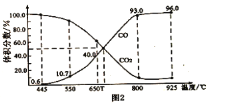
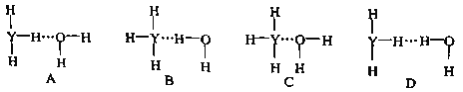
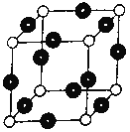
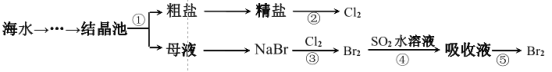
题目内容
【题目】设NA为阿伏加德罗常数,下列说法正确的是( )
A.17g由H2S与PH3组成的混合气体中含有的质子数为9NA
B.90g果糖(C6H12O6,分子中无环状结构和碳碳双键)中含有的非极性键数目为3NA
C.1mol由乙醇与二甲醚(CH3-O-CH3)组成的混合物中含有的羟基数目为NA
D.已知![]() Ra→X+
Ra→X+![]() He,则0.5molX中含有的中子数为34NA
He,则0.5molX中含有的中子数为34NA
【答案】A
【解析】
A. 假设17g全部为H2S,含有质子物质的量为![]() =9mol,假设全部为PH3,含有质子物质的量为
=9mol,假设全部为PH3,含有质子物质的量为![]() =9mol,则17g该混合物中含有的质子物质的量为9mol,故A正确;
=9mol,则17g该混合物中含有的质子物质的量为9mol,故A正确;
B. 果糖结构简式为CH2OHCH(OH)CH(OH)CH(OH)COCH2OH,根据果糖的结构简式,非极性键应是C-C之间的键,90g果糖中含有非极性键的物质的量为![]() =2.5mol,故B错误;
=2.5mol,故B错误;
C. 乙醇结构简式为CH3CH2OH,乙醚的结构简式为CH3-O-CH3,前者含有羟基,后者不含羟基,因此1mol该混合物中含有羟基物质的量应在0~1mol之间,故C错误;
D. 推出X的原子结构为![]() ,0.5molX中含有中子物质的量为0.5mol×(222-86)=68mol,故D错误;
,0.5molX中含有中子物质的量为0.5mol×(222-86)=68mol,故D错误;
答案:A。

【题目】(1)室温下,在0.5 mol/L的纯碱溶液中加入少量水,由水电离出的c(H+)·c(OH-)_______ (填“变大”、“变小”、“不变”)。
(2)已知Ksp(Ag2CrO4)=1.0×10-12,向0.2 moL的AgNO3溶液中加入等体积的0.08 mol/L K2CrO4溶液,则溶液中的c(CrO42-)=________。
(3)室温下,0.1 mol/L NaHCO3溶液的pH值________0.1 mol/LNa2SO3溶液的pH值(填“>”、“<”、“=”)。
已知:
酸 | 电离平衡常数 | |
H2CO3 | K1=4.3×10-7 | K2=5.6×10-11 |
H2SO3 | K1=1.54×10-2 | K2=1.02×10-7 |
(4)有一种可充电电池Na—Al/FeS,电池工作时Na+的物质的量保持不变,并且是用含![]() 的导电固体作为电解质,已知该电池正极反应式为2Na++FeS+2e-=Na2S+Fe,该电池在充电时,阳极发生反应的物质是________,放电时负极反应式为________。
的导电固体作为电解质,已知该电池正极反应式为2Na++FeS+2e-=Na2S+Fe,该电池在充电时,阳极发生反应的物质是________,放电时负极反应式为________。