题目内容
工业上从电解精炼铜的阳极泥(含金、银、铜、硒等单质)中提取硒的湿法工艺流程如图1:
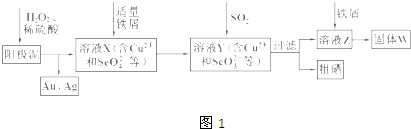
(1)向溶液X中加入铁屑的作用是 ,此操作中不能加入过量铁粉的原因是 .
(2)检验溶液Z中阴离子的操作方法是 .
(3)过滤操作中要用到玻璃棒,请另举两例用到玻璃棒的实验或操作: .
(4)实验室中制取SO2的原理为:Na2SO3+H2SO4═Na2SO4+H2O+SO2↑,此处应使用 (填“较浓的硫酸”或“稀硫酸”),原因是 .制取SO2的装置,最好选用如图2中的 .

(5)粗硒中硒的含量可用如下方法测定:①Se+2H2SO4(浓)═2SO2↑+2H2O.②SeO2+4KI+4HNO3═Se+2I2+4KNO3+H2O,③I2+2Na2S2O3═Na2S4O6+2NaI+通过用Na2S2O3标准溶液(显碱性)滴定反应②中生成的I2来计算硒的含量.滴定操作中用到的玻璃仪器有 .实验中准确称量0.1200g粗硒样品,滴定中消耗0.2000molL-1的Na2S2O3溶液27.60mL,则粗硒样品中硒的质量分数为 .

(1)向溶液X中加入铁屑的作用是
(2)检验溶液Z中阴离子的操作方法是
(3)过滤操作中要用到玻璃棒,请另举两例用到玻璃棒的实验或操作:
(4)实验室中制取SO2的原理为:Na2SO3+H2SO4═Na2SO4+H2O+SO2↑,此处应使用

(5)粗硒中硒的含量可用如下方法测定:①Se+2H2SO4(浓)═2SO2↑+2H2O.②SeO2+4KI+4HNO3═Se+2I2+4KNO3+H2O,③I2+2Na2S2O3═Na2S4O6+2NaI+通过用Na2S2O3标准溶液(显碱性)滴定反应②中生成的I2来计算硒的含量.滴定操作中用到的玻璃仪器有
考点:物质分离和提纯的方法和基本操作综合应用,制备实验方案的设计
专题:实验设计题
分析:(1)根据流程图分析加入铁屑后溶液中的离子变化;根据铁粉具有较强的还原性,结合溶液中的离子分析;
(2)根据流程图可知前面加入二氧化硫,则溶液中有硫酸根离子,根据检验硫酸根的方法分析;
(3)根据玻璃棒在实验中的作用分析;
(4)二氧化硫在水中的溶解度较大,在浓硫酸中溶解度较小;根据反应的特点选择装置;
(5)Na2S2O3标准溶液显碱性应用碱式滴定管盛放,待测溶液用锥形瓶盛放;根据反应的方程式可知,SeO2~2I2~4Na2S2O3,根据n=cV计算消耗的n(Na2S2O3),根据关系式计算样品中n(SeO2),再根据m=nM计算Se的质量,进而计算样品中Se的质量分数.
(2)根据流程图可知前面加入二氧化硫,则溶液中有硫酸根离子,根据检验硫酸根的方法分析;
(3)根据玻璃棒在实验中的作用分析;
(4)二氧化硫在水中的溶解度较大,在浓硫酸中溶解度较小;根据反应的特点选择装置;
(5)Na2S2O3标准溶液显碱性应用碱式滴定管盛放,待测溶液用锥形瓶盛放;根据反应的方程式可知,SeO2~2I2~4Na2S2O3,根据n=cV计算消耗的n(Na2S2O3),根据关系式计算样品中n(SeO2),再根据m=nM计算Se的质量,进而计算样品中Se的质量分数.
解答:
解:(1)根据流程图可知加入铁屑后溶液中的SeO42-被还原为SeO32-,所以向溶液X中加入铁屑的作用是:将SeO42-还原为SeO32-;铁粉具有较强的还原性,能还原Cu2+、SeO32-,所以加过量铁粉会将Cu2+、SeO32-均还原为单质,不利于硒的分离;
故答案为:将SeO42-还原为SeO32-;过量铁粉会将Cu2+、SeO32-均还原为单质,不利于硒的分离;
(2)根据流程图可知前面加入二氧化硫,则溶液中有硫酸根离子,检验硫酸根的方法为:取溶液X少许置于试管中,滴加盐酸酸化的BaCl2溶液,有白色沉淀生成,说明溶液中含有SO42-;
故答案为:取溶液X少许置于试管中,滴加盐酸酸化的BaCl2溶液,有白色沉淀生成,说明溶液中含有SO42-;
(3)实验操作中常常用到玻璃棒,溶解时用玻璃杯搅拌,过滤时用玻璃棒引流,溶液蒸发用玻璃杯搅拌等;
故答案为:物质的溶解、溶液的蒸发;
(4)二氧化硫在水中的溶解度较大,在浓硫酸中溶解度较小,用较浓的硫酸有利于 SO2的逸出,所以选用较浓的硫酸与亚硫酸钠反应;根据实验室中制取SO2的原理为:Na2SO3+H2SO4═Na2SO4+H2O+SO2↑,可知该反应为固体粉末与液体的反应,不需要加热,使用分液漏斗加硫酸容易控制加入硫酸的量,所以最好选用如图2中的b;
故答案为:较浓的硫酸;SO2易溶于水,用较浓的硫酸有利于SO2的逸出;b;
(5)Na2S2O3标准溶液显碱性应用碱式滴定管盛放,待测溶液用锥形瓶盛放,则滴定操作中用到的玻璃仪器有锥形瓶、碱式滴定管;
根据反应的方程式可知SeO2~2I2~4Na2S2O3,消耗的n(Na2S2O3)=0.2000 mol/L×0.0276L=0.00552mol,
根据关系式计算样品中n(SeO2)=0.00552mol×
=0.00138mol,故Se的质量为0.00138mol×79g/mol=0.10902g,
所以样品中Se的质量分数为
×100%=90.85%,
故答案为:锥形瓶、碱式滴定管;90.85%.
故答案为:将SeO42-还原为SeO32-;过量铁粉会将Cu2+、SeO32-均还原为单质,不利于硒的分离;
(2)根据流程图可知前面加入二氧化硫,则溶液中有硫酸根离子,检验硫酸根的方法为:取溶液X少许置于试管中,滴加盐酸酸化的BaCl2溶液,有白色沉淀生成,说明溶液中含有SO42-;
故答案为:取溶液X少许置于试管中,滴加盐酸酸化的BaCl2溶液,有白色沉淀生成,说明溶液中含有SO42-;
(3)实验操作中常常用到玻璃棒,溶解时用玻璃杯搅拌,过滤时用玻璃棒引流,溶液蒸发用玻璃杯搅拌等;
故答案为:物质的溶解、溶液的蒸发;
(4)二氧化硫在水中的溶解度较大,在浓硫酸中溶解度较小,用较浓的硫酸有利于 SO2的逸出,所以选用较浓的硫酸与亚硫酸钠反应;根据实验室中制取SO2的原理为:Na2SO3+H2SO4═Na2SO4+H2O+SO2↑,可知该反应为固体粉末与液体的反应,不需要加热,使用分液漏斗加硫酸容易控制加入硫酸的量,所以最好选用如图2中的b;
故答案为:较浓的硫酸;SO2易溶于水,用较浓的硫酸有利于SO2的逸出;b;
(5)Na2S2O3标准溶液显碱性应用碱式滴定管盛放,待测溶液用锥形瓶盛放,则滴定操作中用到的玻璃仪器有锥形瓶、碱式滴定管;
根据反应的方程式可知SeO2~2I2~4Na2S2O3,消耗的n(Na2S2O3)=0.2000 mol/L×0.0276L=0.00552mol,
根据关系式计算样品中n(SeO2)=0.00552mol×
| 1 |
| 4 |
所以样品中Se的质量分数为
| 0.10902g |
| 0.1200g |
故答案为:锥形瓶、碱式滴定管;90.85%.
点评:本题以工艺流程图为知识背景,考查了氧化还原反应、离子检验、基本实验操作、物质纯度的测定及技术等,题目涉及的知识点较多,考查学生对知识的综合应用能力,题目难度中等.

练习册系列答案
相关题目
下列化学用语正确的是( )
A、HCl的电子式: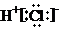 |
| B、C-12原子:12C |
| C、乙酸的结构简式:C2H4O2 |
| D、NH3?H2O的电离方程式:NH3?H2O→NH4++OH- |
化合物丙可由如图反应得到:丙的结构不可能是( )
C4H10O(甲)
C4H8
(乙) C4H8Br2(丙)
C4H10O(甲)
| 浓H2SO4 |
| △ |
| Br2 |
| CCl4 |
| A、CH3CBr2CH2CH3 |
| B、(CH3)2CBrCH2Br |
| C、C2H5CHBrCH2Br |
| D、CH3(CHBr)2CH3 |
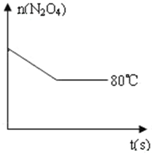 在80℃时,0.40mol的N2O4气体充入2L固定容积的密闭容器中发生如下反应:N2O4(g)?2NO2(g)△H>0,隔一段时间对该容器内的物质进行分析得到如下数据:
在80℃时,0.40mol的N2O4气体充入2L固定容积的密闭容器中发生如下反应:N2O4(g)?2NO2(g)△H>0,隔一段时间对该容器内的物质进行分析得到如下数据: 和一个-Cl,它可能的结构有
和一个-Cl,它可能的结构有 已知A、D为短周期单质,B、C是短周期元素的化合物,关系如图.
已知A、D为短周期单质,B、C是短周期元素的化合物,关系如图. 电解饱和食盐水装置的结构如图所示:
电解饱和食盐水装置的结构如图所示: