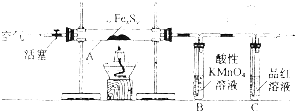
题目内容
用0.01mol/L H2SO4滴定0.01mol/L NaOH溶液,中和后再加水至100mL.若滴定时终点判断有误差:(1)多加了1滴H2SO4,(2)少加了1滴H2SO4(设1滴为0.05mL),则(1)和(2)两溶液的pH相差( )
| A、1 | B、2 | C、3 | D、4 |
分析:一滴0.01mol/L H2SO4的物质的量为n(H2SO4)=0.01mol/L×0.05×10-3L=5×10-7mol;多滴了一滴硫酸,滴完后溶液中氢离子浓度c(H+)=5×10-7mol×2/0.01=10-4mol/L;少滴了一滴硫酸,溶液中n(OH-)等于少滴的1滴硫酸中的氢离子物质的量.
解答:解:(1)多加了1滴H2SO4,溶液显示酸性,一滴硫酸中n(H2SO4)=0.01mol/L×0.05×10-3L=5×10-7mol,溶液中c(H+)=5×10-7mol×2/0.1=10-5mol/L,PH=5;
(2)少滴了一滴硫酸,溶液显碱性,n(OH-)等于1滴硫酸的物质的量,c(OH-)=10-5mol/L,该溶液中c(H+)=10-9,PH=9,故两溶液相差4,D正确;
故选D.
(2)少滴了一滴硫酸,溶液显碱性,n(OH-)等于1滴硫酸的物质的量,c(OH-)=10-5mol/L,该溶液中c(H+)=10-9,PH=9,故两溶液相差4,D正确;
故选D.
点评:本题考查中和滴定误差分析,同时考查了溶液PH的求算,难度适中.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目