题目内容
某研究性学习小组对过量炭粉与氧化铁反应中气体产物的成分进行了研究。
【提出假设】该反应中的气体产物可能是CO或者是CO2和CO的混合物。
【查阅资料】氮气不与碳、氧化铁发生反应。实验室可以用饱和氯化铵溶液和饱和亚硝酸钠(NaNO2)溶液混合加热反应制得氮气。
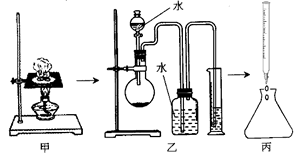
【设计方案】如图所示,将一定量的氧化铁在隔绝空气的条件下与过量炭粉完全反应,测定参加反应的碳元素与氧元素的质量比。

试回答下列问题:
(1)广口瓶内盛放的试剂为 ,其作用为
(2)实验开始时,应先打开弹簧夹,一段时间后关闭;再点燃酒精喷灯,理由是
(3)称取3.20g氧化铁、2.00g炭粉混合均匀,放入质量为48.48g的硬质玻璃管中;待反应结束,再通一段时间的氮气。冷却至室温,称得硬质玻璃管和固体总质量为51.24g。经进一步测定得知参加反应的氧元素质量为0.96g。从而确认该反应的气体产物是CO2和CO的混合物,理由是 。根据数据处理结果判断,反应产生的气体中n(CO2):n(CO)= 。
(4)有同学认为还应对该实验装置作进一步完善,你认为应作如何改进?
(1)浓硫酸,吸收产生的氮气中的水,获得干燥的氮气。
(2)为了排尽整套装置中的空气。
(3)经计算反应后的气体中碳、氧原子的物质的量之比为2:3,介于1/2和1之间。1:1。
(4)在尾气出口处加一点燃的酒精灯或增加一尾气处理装置

 全能测控一本好卷系列答案
全能测控一本好卷系列答案二氧化氮(NO2)是一种具有高度活性的气态物质,NO2与Na2O2均具有较强的氧化性,某研究性学习小组对二者能否发生反应进行探究。
【实验】
下列关于实验室制备NO2的说法正确的是_______
a.实验室常用铜和浓硝酸反应制取二氧化氮
b.二氧化氮常用向下排空气法收集
c.二氧化氮易溶于水,尾气可用水吸收.
d.用注射器收集的二氧化氮,压缩后颜色变浅
e.实验后容器中残留液需用碱液处理
【提出假设】
假设一:NO2与Na2O2二者不反应;
假设二:NO2能被Na2O2氧化;
假设三:
【查阅文献】
NO2在反应中能生成HNO3和HNO2;HNO2旣有氧化性,又有还原性,能被强氧化剂如KMnO4氧化。
【设计实验】
(1)实验时,将NO2气体通入盛有Na2O2的玻璃管中,淡黄色粉末完全变成白色,说明假设 不成立。
(2)若假设二成立,反应的化学方程式是 。
(3)为验证假设二是否成立,该小组同学做了如下定性实验研究,请完成下表内容。
|
实验步骤 (不要求写具体操作过程,仪器任选) |
预期的实验现象及结论 |
|
取适量的白色固体置于试管中,………… |
|
【定量分析】
若实验前该小组同学用托盘天平称量过氧化钠的质量为3.9g,充分反应后白色固体质量为8.4g,该小组同学得出假设2不成立的结论。你是否同意他们的结论,并简述理由: