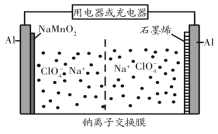
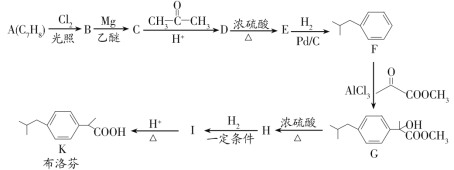
题目内容
【题目】常温下,向10mL一定浓度的硝酸银溶液中,逐滴加入0.1mol·L-1的氨水,反应过程中-1gc(Ag+)或-1gc[Ag(NH3)2+]与加入氨水体积的关系如图。下列说法错误的是( )
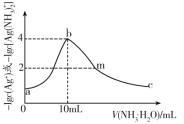
A.原硝酸银溶液的浓度是0.1mol·L-1
B.反应生成氢氧化银的Ksp(AgOH)的数量级为10-8
C.溶液b点NH4+的浓度小于溶液c点NH4+的浓度
D.溶液m点c(NO3-)>c(Ag+)+c[Ag(NH3)2+]+c(NH4+)
【答案】CD
【解析】
向10mL一定浓度的硝酸银溶液中,逐滴加入0.1mol·L-1的氨水,首先发生反应Ag++NH3·H2O=AgOH↓+NH4+,继而发生AgOH+2NH3·H2O=Ag(NH3)2++2H2O+OH-;b点-1gc(Ag+)达到最大值,可认为此时Ag+与NH3·H2O恰好完全反应,银离子完全沉淀。
A.b点完全反应,此时加入的氨水为10mL,氨水的浓度为0.1mol/L,原硝酸银溶液也为10mL,根据方程式Ag++NH3·H2O=AgOH↓+NH4+可知,硝酸银溶液的浓度为0.1mol/L,故A正确;
B.b点溶液溶质为NH4NO3,Ag+完全沉淀,存在沉淀溶解平衡AgOH![]() Ag++OH-,所以可以近似地认为c(Ag+)=c(OH-),此时-1gc(Ag+)=4,则c(Ag+)= c(OH-)=1×10-4mol/L,Ksp(AgOH)= c(Ag+)·c(OH-)=1×10-8,故B正确;
Ag++OH-,所以可以近似地认为c(Ag+)=c(OH-),此时-1gc(Ag+)=4,则c(Ag+)= c(OH-)=1×10-4mol/L,Ksp(AgOH)= c(Ag+)·c(OH-)=1×10-8,故B正确;
C.b点溶液中溶质为NH4NO3,b到c过程发生反应AgOH+2NH3·H2O=Ag(NH3)2++2H2O+OH-,随着氨水的加入,并没有引入铵根离子,虽然碱性增强铵根的水解受到抑制,但溶液的体积增加的幅度更大,所以铵根离子的浓度减小,即b点NH4+的浓度大于溶液c点NH4+的浓度,故C错误;
D.m点溶液存在电荷守恒c(OH-)+c(NO3-)=c(Ag+)+c[Ag(NH3)2+]+c(NH4+)+c(H+),此时加入 了过量的氨水,溶液应呈碱性,即c(OH-)> c(H+),则c(NO3-)<c(Ag+)+c[Ag(NH3)2+]+c(NH4+),故D错误;
故答案为CD。

 阅读快车系列答案
阅读快车系列答案【题目】在如图所示的装置中,烧瓶中充满干燥气体a,将滴管中的液体b挤入烧瓶内,轻轻振荡烧瓶,然后打开弹簧夹f,烧杯中的液体d呈喷泉状喷出,最终几乎充满烧瓶。则a和b分别是
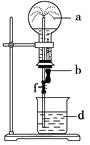
|
| |
A. |
| 水 |
B. |
| 4mol/LNaHSO3溶液 |
C. | Cl2 | 饱和NaCl水溶液 |
D. |
| 1mol/L盐酸 |
A.AB.BC.CD.D