题目内容
Ⅰ:将相同体积的A,B,C,D四种酸或碱(HA,HB,ROH,DOH)溶液室温下加水稀释.稀释过程中溶液pH值与溶液体积的变化关系如图所示.根据图中曲线分析,填写下列空白:
(1)稀释前,这四种溶液浓度由大到小顺序为 .
(2)稀释前HA溶液中的C(H+)和DOH溶液中的C(OH-)大小关系是 .
(3)取稀释前的ROH溶液和HB溶液等体积混合,充分反应后,溶液中溶质离子浓度的大小关系是 .
Ⅱ:草酸(H2C2O4)是二元弱酸,KHC2O4溶液呈酸性.向10mL 0.01mol?L-1的H2C2O4溶液滴加0.01mol?L-1KOH溶液V(mL),回答下列问题.
①当V<10mL时,反应的离子方程式为: .
②当V=10mL时,溶液中HC2O4-、C2O42-、H2C2O4、H+的浓度从大到小的顺序为: .
③当V=amL时,溶液中离子浓度有如下关系:c(K+)=2c(C2O42-)+c(HC2O4-);当V=bmL时,溶液中离子浓度有如下关系:c(K+)=c(C2O42-)+c(HC2O4-)+c(H2C2O4);则:a b (填“<”,“=”或“>”).
④当V=20mL时,再滴入NaOH溶液,则溶液中n(K+)/n(C2O42-)的值将: (填“变大”,“变小”,“不变”).

(1)稀释前,这四种溶液浓度由大到小顺序为
(2)稀释前HA溶液中的C(H+)和DOH溶液中的C(OH-)大小关系是
(3)取稀释前的ROH溶液和HB溶液等体积混合,充分反应后,溶液中溶质离子浓度的大小关系是
Ⅱ:草酸(H2C2O4)是二元弱酸,KHC2O4溶液呈酸性.向10mL 0.01mol?L-1的H2C2O4溶液滴加0.01mol?L-1KOH溶液V(mL),回答下列问题.
①当V<10mL时,反应的离子方程式为:
②当V=10mL时,溶液中HC2O4-、C2O42-、H2C2O4、H+的浓度从大到小的顺序为:
③当V=amL时,溶液中离子浓度有如下关系:c(K+)=2c(C2O42-)+c(HC2O4-);当V=bmL时,溶液中离子浓度有如下关系:c(K+)=c(C2O42-)+c(HC2O4-)+c(H2C2O4);则:a
④当V=20mL时,再滴入NaOH溶液,则溶液中n(K+)/n(C2O42-)的值将:
考点:酸碱混合时的定性判断及有关ph的计算,弱电解质在水溶液中的电离平衡
专题:电离平衡与溶液的pH专题
分析:Ⅰ:(1)溶液酸性或者碱性越强,稀释到相同体积时溶液的pH变化越大,根据图象曲线中pH的变化判断电解质电离能力强弱,电离程度越小,则溶液浓度越大,然后该溶液中浓度大小;
(2)稀释前溶液中氢离子、氢氧根离子浓度都是0.001mol/L;
(3)根据浓度c(HB)>c(ROH)判断溶液酸碱性,然后根据电荷守恒判断溶液中各离子浓度大小;
Ⅱ:①当V<10mL时,草酸过量,H2C2O4和KOH反应生成KHC2O4;
②当V=10mL时,草酸与氢氧化钾恰好反应生成草酸氢钾,根据草酸氢钾溶液显示酸性及电荷守恒判断溶液中各离子浓度大小;
③当V=amL时,溶液中离子浓度有如下关系:c(K+)=2c(C2O42-)+c(HC2O4-),依据溶液中电荷守恒分析氢离子浓度和氢氧根离子浓度相同判断;当V=bmL时,溶液中离子浓度有如下关系:c(K+)=c(C2O42-)+c(HC2O4-)+c(H2C2O4),根据溶液中物料守恒分析,溶质为KHC2O4;
④当V=20mL时,反应生成K2C2O4,再滴入NaOH溶液,抑制盐类的水解,n(K+)/n(C2O42-)的值将减小.
(2)稀释前溶液中氢离子、氢氧根离子浓度都是0.001mol/L;
(3)根据浓度c(HB)>c(ROH)判断溶液酸碱性,然后根据电荷守恒判断溶液中各离子浓度大小;
Ⅱ:①当V<10mL时,草酸过量,H2C2O4和KOH反应生成KHC2O4;
②当V=10mL时,草酸与氢氧化钾恰好反应生成草酸氢钾,根据草酸氢钾溶液显示酸性及电荷守恒判断溶液中各离子浓度大小;
③当V=amL时,溶液中离子浓度有如下关系:c(K+)=2c(C2O42-)+c(HC2O4-),依据溶液中电荷守恒分析氢离子浓度和氢氧根离子浓度相同判断;当V=bmL时,溶液中离子浓度有如下关系:c(K+)=c(C2O42-)+c(HC2O4-)+c(H2C2O4),根据溶液中物料守恒分析,溶质为KHC2O4;
④当V=20mL时,反应生成K2C2O4,再滴入NaOH溶液,抑制盐类的水解,n(K+)/n(C2O42-)的值将减小.
解答:
解:Ⅰ:(1)根据图象曲线变化可知,稀释四种溶液过程中,溶液的pH变化大小为:c(HB)<c(DOH)<c(ROH)<c(HA),则电解质的电离程度大小为:c(HB)<c(DOH)<c(ROH)<c(HA),溶质的电离程度越大,则浓度越中离子浓度大小为:c(HB)>c(DOH)>c(ROH)>c(HA),
故答案为:c(HB)>c(DOH)>c(ROH)>c(HA);
(2)根据图象可知,稀释前HA溶液的pH=3,则溶液中中的c(H+)=0.001mol/L,DOH溶液的pH=11,则溶液中c(OH-)=0.003mol/L,所以稀释前HA溶液中的(H+)和DOH溶液中的c(OH-)x相等,
故答案为:相等;
(3)由于稀释前浓度:c(HB)>c(ROH),等体积混合后HB过量溶液显示酸性,则c(H+)>c(OH-),根据电荷守恒可知,c(B-)>c(R+),则溶液中各离子浓度大小为:c(B-)>c(R+)>c(H+)>c(OH-),
故答案为:c(B-)>c(R+)>c(H+)>c(OH-);
Ⅱ:①当V<10mL时,H2C2O4和KOH反应生成KHC2O4,反应的离子方程式为:H2C2O4+OH-=HC2O4-+H2O,故答案为:H2C2O4+OH-=HC2O4-+H2O;
②向10mL 0.01mol?L-1的H2C2O4溶液滴加0.01mol?L-1KOH溶液,当V=10mL时,草酸与氢氧化钾恰好反应生成草酸氢钾,由于草酸氢钾溶液显示酸性,则HC2O4-的电离程度大于其水解程度,所以c(C2O42-)>c(H2C2O4),由于氢离子来自水的电离和HC2O4-的电离,则c(H+)>c(C2O42-),HC2O4-的水解程度较小,则c(HC2O4-)>c(C2O42-),所以溶液中各离子浓度大小为c(HC2O4-)>c(H+)>c(C2O42-)>c(H2C2O4),
故答案为:c(HC2O4-)>c(H+)>c(C2O42-)>c(H2C2O4);
③c(Na+)=2c(C2O42-)+c(HC2O4-),根据电荷守恒c(Na+)+c(H+)=2c(C2O42-)+c(HC2O4-)+c(OH-)可得,则c(H+)=c(OH-),所以溶液呈中性,pH=7,草酸氢钾溶液呈酸性,要使溶液呈中性,则氢氧化钠应该稍微过量,所以V(NaOH)=a>10mL;
溶液中离子浓度有如下关系:c(K+)=c(C2O42-)+c(HC2O4-)+c(H2C2O4)根据溶液中物料守恒分析,溶质为KHC2O4,说明V(NaOH)=b=10mL,则a>b,
故答案为:>;
④当V=20mL时,反应生成K2C2O4,再滴入NaOH溶液,抑制盐类的水解,n(K+)/n(C2O42-)的值将减小;因为溶液中存在如下平衡C2O42-+H2O?HC2O4-+OH-,当增大c(OH-)时,平衡向逆方向移动,n(C2O42-)的值变大,而n(K+)的值不变,故n(K+)/n(C2O42-)的值变小,
故答案为:变小.
故答案为:c(HB)>c(DOH)>c(ROH)>c(HA);
(2)根据图象可知,稀释前HA溶液的pH=3,则溶液中中的c(H+)=0.001mol/L,DOH溶液的pH=11,则溶液中c(OH-)=0.003mol/L,所以稀释前HA溶液中的(H+)和DOH溶液中的c(OH-)x相等,
故答案为:相等;
(3)由于稀释前浓度:c(HB)>c(ROH),等体积混合后HB过量溶液显示酸性,则c(H+)>c(OH-),根据电荷守恒可知,c(B-)>c(R+),则溶液中各离子浓度大小为:c(B-)>c(R+)>c(H+)>c(OH-),
故答案为:c(B-)>c(R+)>c(H+)>c(OH-);
Ⅱ:①当V<10mL时,H2C2O4和KOH反应生成KHC2O4,反应的离子方程式为:H2C2O4+OH-=HC2O4-+H2O,故答案为:H2C2O4+OH-=HC2O4-+H2O;
②向10mL 0.01mol?L-1的H2C2O4溶液滴加0.01mol?L-1KOH溶液,当V=10mL时,草酸与氢氧化钾恰好反应生成草酸氢钾,由于草酸氢钾溶液显示酸性,则HC2O4-的电离程度大于其水解程度,所以c(C2O42-)>c(H2C2O4),由于氢离子来自水的电离和HC2O4-的电离,则c(H+)>c(C2O42-),HC2O4-的水解程度较小,则c(HC2O4-)>c(C2O42-),所以溶液中各离子浓度大小为c(HC2O4-)>c(H+)>c(C2O42-)>c(H2C2O4),
故答案为:c(HC2O4-)>c(H+)>c(C2O42-)>c(H2C2O4);
③c(Na+)=2c(C2O42-)+c(HC2O4-),根据电荷守恒c(Na+)+c(H+)=2c(C2O42-)+c(HC2O4-)+c(OH-)可得,则c(H+)=c(OH-),所以溶液呈中性,pH=7,草酸氢钾溶液呈酸性,要使溶液呈中性,则氢氧化钠应该稍微过量,所以V(NaOH)=a>10mL;
溶液中离子浓度有如下关系:c(K+)=c(C2O42-)+c(HC2O4-)+c(H2C2O4)根据溶液中物料守恒分析,溶质为KHC2O4,说明V(NaOH)=b=10mL,则a>b,
故答案为:>;
④当V=20mL时,反应生成K2C2O4,再滴入NaOH溶液,抑制盐类的水解,n(K+)/n(C2O42-)的值将减小;因为溶液中存在如下平衡C2O42-+H2O?HC2O4-+OH-,当增大c(OH-)时,平衡向逆方向移动,n(C2O42-)的值变大,而n(K+)的值不变,故n(K+)/n(C2O42-)的值变小,
故答案为:变小.
点评:本题考查了酸碱混合的定性判断及溶液中离子浓度大小比较方法,题目难度中等,注意掌握酸碱中和反应中过量情况的判断与计算方法,能够根据电荷守恒、物料守恒、盐的水解原理判断溶液中离子浓度大小.

练习册系列答案
相关题目
下列说法正确的是( )
| A、Cl2、SO2均能使品红溶液褪色,说明二者均有氧化性 |
| B、能使湿润的淀粉KI试纸变成蓝色的物质一定是Cl2 |
| C、SiO2与酸、碱均不反应 |
| D、分别充满HCl、NH3的烧瓶倒置于水中后液面均迅速上升,说明二者均易溶于水 |
下列反应不符合绿色化学基本原则的是( )
| A、除硫酸厂尾气:SO2+2NH3+H2O═(NH4)2SO3 | ||||
| B、消除硝酸工业尾气氮氧化物的污染:2NaOH+NO2+NO═2NaNO2+H2O | ||||
C、制备CuSO4:Cu+2H2SO4(浓)
| ||||
D、制备CuSO4:2Cu+O2
|
现有BaCl2和NaCl的混合溶液a L,分成两份,一份滴加稀硫酸,除去Ba2+;另一份滴加硝酸银溶液,除去Cl-,反应中消耗稀硫酸x mol,硝酸银y mol,则原溶液中的Na+的物质的量浓度为 .
根据如图所示的过程中的能量变化情况,判断下列说法正确的是( )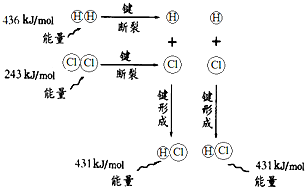

| A、H2(g)和Cl2(g)反应生成HCl(g)是吸热反应 |
| B、2个H原子结合生成一个H2分子时放出436kJ能量 |
| C、1molHCl(g)分子中的化学键断裂时需要吸收862kJ能量 |
| D、H2(g)+Cl2(g)═2HCl(g)的反应热△H=-183kJ?mol-1 |

