题目内容
3.电子构型为[Ar]3d54s2的元素是( )| A. | ds区元素 | B. | 过渡元素 | C. | 主族元素 | D. | s区元素 |
分析 元素的能层数等于其周期数,从第ⅢB族到第ⅥB族,其外围电子数等于其族序数,而第ⅠB族、第ⅡB族,其最外层电子数等于其族序数,据此分析解答.
解答 解:元素外围电子构型为3d54s2,根据电子排布式知,该原子含有4个能层,所以位于第四周期,外围电子总数为7,即处于ⅦB族,故该元素位于第四周期第ⅦB族,是过渡元素,故选:B.
点评 本题考查了结构与位置关系,根据能层与周期、价电子与族的关系即可解答,难度中等.

练习册系列答案
相关题目
14.化学于生产、生活,并应用于生产、生活,下列有关说法不正确的是( )
| A. | 明矾能水解生成氢氧化铝胶体,可用作净水剂 | |
| B. | 石英、玛瑙、水晶通常作为装饰品使用,但都可溶于氢氟酸 | |
| C. | Na2CO3俗称纯碱,可与盐酸反应,故可用于治疗人体内胃酸过多 | |
| D. | 农村施肥时,草木灰不能与铵态氮肥混用,以免氮肥肥效下降 |
11.化学与生产、生活、社会密切相关.下列有关说法中正确的是( )
| A. | 2008年北京奥运会开幕式上的“脚印”等焰火让全世界为之欢呼、倾倒,这主要是利用了“焰色反应”这一化学反应放出的能量 | |
| B. | 食盐中因为含有少量CaCl2、MgCl2晶体易潮解,它们潮解的实质是晶体表面吸水形成溶液 | |
| C. | 2013年11月,中科院国家纳米科学中心首次“拍”到氢键的“照片”,直观地证实了水分子间的氢键是一个水分子中的氢原子与另一个水分子中的氧原子间形成的化学键 | |
| D. | 神七宇航员所穿航天服是由我国自行研制的新型“连续纤维增韧”航空材料做成,其主要成分是由碳化硅、陶瓷和碳纤维复合而成的,它是一种新型有机高分子材料 |
8.下列分子中所有原子都满足最外层8电子结构的是( )
①光气(COCl2) ②六氟化硫 ③HCHO ④三氟化硼 ⑤PCl3 ⑥PCl5 ⑦NO2 ⑧二氟化氙 ⑨N2 ⑩CH4.
①光气(COCl2) ②六氟化硫 ③HCHO ④三氟化硼 ⑤PCl3 ⑥PCl5 ⑦NO2 ⑧二氟化氙 ⑨N2 ⑩CH4.
| A. | ⑥⑦⑨ | B. | ①⑤⑨ | C. | ①④⑤⑦ | D. | ①④⑤⑨ |
15.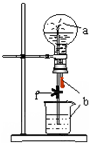 如图装置中,烧瓶中充满干燥气体a,将滴管中的液体b挤入烧瓶内,轻轻振荡烧瓶,然后打开弹簧夹f,烧杯中的液体b呈喷泉状喷出,最终几乎充满烧瓶.则a和b分别是
如图装置中,烧瓶中充满干燥气体a,将滴管中的液体b挤入烧瓶内,轻轻振荡烧瓶,然后打开弹簧夹f,烧杯中的液体b呈喷泉状喷出,最终几乎充满烧瓶.则a和b分别是
( )
 如图装置中,烧瓶中充满干燥气体a,将滴管中的液体b挤入烧瓶内,轻轻振荡烧瓶,然后打开弹簧夹f,烧杯中的液体b呈喷泉状喷出,最终几乎充满烧瓶.则a和b分别是
如图装置中,烧瓶中充满干燥气体a,将滴管中的液体b挤入烧瓶内,轻轻振荡烧瓶,然后打开弹簧夹f,烧杯中的液体b呈喷泉状喷出,最终几乎充满烧瓶.则a和b分别是 | a(干燥气体) | b(液体) | |
| A | NO2 | 水 |
| B | CO2 | 饱和NaHCO3溶液 |
| C | Cl2 | 饱和NaCl水溶液 |
| D | NH3 | NaNO3稀溶液 |
| A. | A | B. | B | C. | C | D. | D |
12.下列关于NO的叙述正确的是( )
| A. | NO是一种红棕色的气体 | |
| B. | 常温常压下NO不能与空气中的氧气直接化合 | |
| C. | 含等质量的氧元素的NO和CO的物质的量相等 | |
| D. | NO易溶于水,不能用排水法收集 |
20. 甲醇是重要的化工原料,在化工生产中有广泛的应用.
甲醇是重要的化工原料,在化工生产中有广泛的应用.
(1)电子工业中使用的一氧化碳常以甲醇为原料通过脱氢反应生成H2和甲酸甲酯(HCOOCH3)、再分解生成CO和CH3OH.写出相应反应的化学方程式:2CH3OH→HCOOCH3+2H2↑、HCOOCH3→CH3OH+CO↑.
(2)利用太阳能或生物质能分解水制H2,然后可将H2与C02转化为甲醇.已知:
光催化制氢:2H2O(1)=2H2(g)+O2(g)△H=+571.5kJ•mol-1
H2与C02耦合反应:3H2(g)十CO2(g)=CH3OH(1)+H2O(1)△H=一137.8kJ•mol-1
则反应:2H2O(1)+CO2(g)=CH30H(l)+3/202(g)的△H=+719.45 kJ•mol-1
(3)已知反应:CO(g)+2H2(g)?CH3OH(g)△H=Q
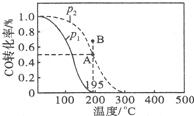
在20L的密闭容器中,按物质的量之比1:2充入CO和H2,测得CO的转化率随温度及压强的变化如图所示,P2及195℃时n(H2)随时间的变化如表所示:
①O~3min,平均速率V(CH3OH)=0.033mol/(L.min),Q<0(填“<”“=”或“>”).
②图中压强(P1、P2)的大小顺序为P1<P2,理由是相同温度下,压强P2平衡时CO的转化率更大,而正反应为气体体积减小的反应,增大压强平衡向正反应方向移动,CO的转化率提高.
③在P2及195℃时,该反应的平衡常数K=25.
 甲醇是重要的化工原料,在化工生产中有广泛的应用.
甲醇是重要的化工原料,在化工生产中有广泛的应用.(1)电子工业中使用的一氧化碳常以甲醇为原料通过脱氢反应生成H2和甲酸甲酯(HCOOCH3)、再分解生成CO和CH3OH.写出相应反应的化学方程式:2CH3OH→HCOOCH3+2H2↑、HCOOCH3→CH3OH+CO↑.
(2)利用太阳能或生物质能分解水制H2,然后可将H2与C02转化为甲醇.已知:
光催化制氢:2H2O(1)=2H2(g)+O2(g)△H=+571.5kJ•mol-1
H2与C02耦合反应:3H2(g)十CO2(g)=CH3OH(1)+H2O(1)△H=一137.8kJ•mol-1
则反应:2H2O(1)+CO2(g)=CH30H(l)+3/202(g)的△H=+719.45 kJ•mol-1
(3)已知反应:CO(g)+2H2(g)?CH3OH(g)△H=Q
在20L的密闭容器中,按物质的量之比1:2充入CO和H2,测得CO的转化率随温度及压强的变化如图所示,P2及195℃时n(H2)随时间的变化如表所示:
| t/min | 0 | 1 | 3 | 5 |
| n(H2)/mol | 8 | 5 | 4 | 4 |
②图中压强(P1、P2)的大小顺序为P1<P2,理由是相同温度下,压强P2平衡时CO的转化率更大,而正反应为气体体积减小的反应,增大压强平衡向正反应方向移动,CO的转化率提高.
③在P2及195℃时,该反应的平衡常数K=25.
 .
.