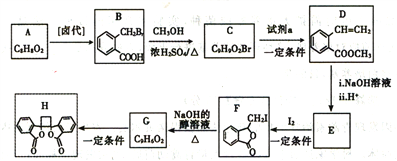
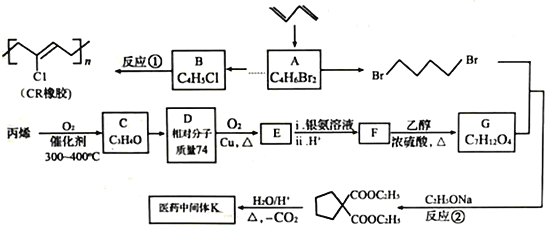
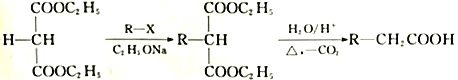��Ŀ����
����Ŀ����ͼΪһ��������ˮ����װ�ã���װ�ÿ�����һ�����ォ�л���ˮ�Ļ�ѧ��ֱ��ת��Ϊ���ܣ���ͼ��һ���ö��Ե缫��ⱥ��ʳ��ˮ������Һ�����������ڼס��ҵ�˵����ȷ����
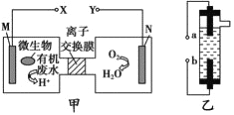
A. װ�����е�b��Ҫ��װ�ü�X������
B. װ������a���ĵ缫��ӦʽΪ:2Cl- -2e-=Cl2��
C. ��N������5.6L(��״����)����ʱ������2NA��H+ͨ�����ӽ���Ĥ
D. ���л���ˮ����Ҫ���������ǣ���װ�ü���M�������ĵ缫��ӦΪ: C6H12O6+6H2O-24e-=6CO2��+24H+
���𰸡�D
������������֪���ͼʾ����Ϊԭ��أ�XΪ������YΪ��������Ϊ�ö��Ե缫��ⱥ��ʳ��ˮ������Һ����������aΪ��������������NaOH��bΪ��������Cl2��������Cl2��NaOH��Ӧ����NaClO��
A�bΪ����������Ӧ��������(Y��)���ӣ���A����B�aΪ�������缫��ӦʽΪ��2H2O+2e-=2OH-+H2����bΪ�������缫��ӦʽΪ��2Cl--2e-=Cl2������B����C���ͼ��N�缫Ϊ�����õ��ӷ�����ԭ��Ӧ���缫��ӦʽΪ��O2+4H++4e-=2H2O����N�缫����5.6L(��״����)����(��0.25mol)ʱ������1mol�����ӣ�����NA��H+ͨ�����ӽ���Ĥ����C����D����л���ˮ����Ҫ���������ǣ���װ�ü���M������C6H12O6ʧ���ӵ�������Ӧ�����ɶ�����̼�����ݵ���غ��ԭ���غ㣬��缫ӦΪ��C6H12O6+6H2O-24e-=6CO2��+24H+����D��ȷ��

 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�����Ŀ���������������뻯ѧ��ص����ݱ���
����ͼ��ij��ͯ��Ԫ����챨�浥�IJ������ݣ�ijҽ�ƻ����ٴ����������浥
������Ŀ | ����� | ��λ | �ο���Χ | |
1 | �Zn�� | 115.92 | ��mol/L | 66~120 |
2 | ����Fe�� | 6.95 | mmol/L | 7.52~11.82 |
3 | �ƣ�Ca�� | 1.68 | mmol/L | 1.55~2.10 |
���� |
�����ϱ������ݣ��ش��������⣺
(1)�ö�ͯ__________Ԫ�غ���ƫ�͡�
(2)���浥������mol/L����__________�������������������������Ũ�������ĵ�λ��
(3)����ά����C��ʹʳ���е�Fe3+ת��ΪFe2+�����������������ά����C��__________��������������������ԭ��������
��������Ϊ���ӳ��ʻ���������ͨ�����ڻ�ƿ�м����ʻ����ʼ����±���0.5Lij���ʻ����ʼ��к��еijɷּ��������Ķ���ش��������⣺
�ɷ� | ����(g) | Ħ������(g/mol) |
�����ǣ�C12H22O11�� | 25.00 | 342 |
0.25 | 174 | |
�۸�����أ�KMnO4�� | 0.25 | 158 |
�ܰ�˾ƥ�֣�C9H8O4�� | 0.17 | 180 |
����������AgNO3�� | 0.02 | 170 |
(4)�����ʻ����ʼ��ɷ��У������ε���__________������ţ���
(5)������500mL���ʻ����ʼ��������²������裺
a���ѳ����õı��ʼ�����С�ձ��У�����������ˮ�ܽ⣻
b����a������ҺС��ת��500mL����ƿ�У�
c������������ƿ�м�����ˮ��Һ���̶�1cm~2cm�������ý�ͷ�ι�С�ĵμ�����ˮ����Һ��Һ����ʹ���̶������У�
d������������ˮϴ���ձ��Ͳ�����2~3�Σ�ÿ��ϴ��Һ��С��ת������ƿ��������ҡ�ȣ�
e��������ƿ�������������µߵ�ҡ�ȡ�
�ٲ����������ȷ˳��Ϊ������ţ�__________��
��������ƿ��ʹ�÷����У����в�������ȷ����__________��
A��ʹ������ƿǰ������Ƿ�©ˮ
B������ƿ������ˮϴ������Ҫ����
C���Ǻ�ƿ������һֻ�ֵ�ʳָ��סƿ������һֻ�ֵ���ָ��סƿ�ף�������ƿ��ת��ҡ������
(6)д�����ʻ����ʼ���K+�����ʵ���Ũ�ȵ�����ʽc(K+)��__________ mol��L1��
����Ŀ��̼�������仯����������������ء������Ҫ��ش���������:
��1����CH4����ԭ��������������������������Ⱦ����֪:
��CH4(g)+4NO2(g)= 4NO(g)+CO2(g)+2H2O(g) ��H=-574kJ/mol
��CH4(g)+4NO(g)= 2N2(g)+CO2(g)+2H2O(g) ��H=-l160kJ/mol
��H2O(g)= H2O(l) ��H=-44kJ/mol
д��CH4(g)��NO2(g)��Ӧ����N2(g)��CO2(g)��H2O( 1) ���Ȼ�ѧ����ʽ_________��
��2����֪: ��ӦI: 4NH3(g)+5O2(g) ![]() 4NO(g)+6H2O(g) ��H < 0
4NO(g)+6H2O(g) ��H < 0
��ӦII: 4NH3(g)+3O2(g) ![]() 2N2(g)+6H2O(g) ��H < 0
2N2(g)+6H2O(g) ��H < 0
���ں��º���װ���г���һ������NH3 ��O2,�ڴ����������½��з�ӦI���������й���������ȷ����___(����ĸ���)��
A.����ѹǿ��Kp(��ѹǿ��ʾ�Ļ�ѧƽ�ⳣ��) ����
B.�����������3v��(NH3)=2v��(H2O) ʱ��˵����Ӧ�Ѵ�ƽ��
C.�����¶ȣ�NH3 ��ת��������
D.�ﵽƽ��ʱ��ϵ��ѹǿ���ٱ仯
����������ʱ�ᷢ����������������ӦI��II��Ϊ����ij�����Ը÷�Ӧ��ѡ���ԣ���1L�ܱ������г���1molNH3��2molO2�����й����ʵ�����ϵ��ͼ���ô����ڸ���ʱѡ��Ӧ_____(����I������II��)��
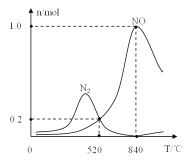
��520��ʱ��4NH3(g)+3O2 (g)![]() 2N2(g)+6H2O(g)��ƽ�ⳣ��K=_______(ֻ���г����ּ���ʽ)�����NH3ת��ΪN2ƽ��ת���ʵĴ�ʩ��______( ����ĸ���)
2N2(g)+6H2O(g)��ƽ�ⳣ��K=_______(ֻ���г����ּ���ʽ)�����NH3ת��ΪN2ƽ��ת���ʵĴ�ʩ��______( ����ĸ���)
A.���ͷ�Ӧ�¶� B.����Ӧ���ɵ�H2O(g)��ʱ�Ƴ�
C.����NH3��O2�ij�ʼͶ�ϱ� D.Ͷ�ϱȲ��䣬���ӷ�Ӧ���Ũ��
��3����֪25��ʱHCN ��H2CO3�ĵ��볣��(Ka.)���±�:
���� | ���볣��(Ka) |
HCN | Ka=5��10-10 |
H2CO3 | Ka1=4.5��10-7��Ka2=4.7�� 10-11 |
25��ʱ�����HCN ��NaCN �Ļ����ҺpH=11,��c(HCN)/c(CN-)=____����NaCN ��Һ��ͨ������CO2��������Ӧ�����ӷ���ʽΪ:__________��