题目内容
SnCl4的制备需分两步进行:第一步是金属Sn的制备,第二步由Sn和Cl2反应生成SnCl4.
第一步:金属Sn的制备--以锡石SnO2为原料,用足量的焦炭作还原剂,在高温下可制得粗锡,该反应的化学方程式为
已知锡与碳同族,粗锡经电解精炼可得纯锡,精炼时的阴极反应式为
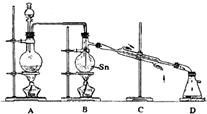
第二步:SnCl4的制备--用干燥、纯净的Cl2与熔融的Sn反应制SnCl4,同时放出大量的热.已知SnCl4常温下是无色液体,沸点114℃,遇潮湿空气便发生水解反应,Sn的熔点:231℃,如图1是制取SnCl4的实验装置.

试回答以下问题:
(1)本试验中检查制气装置A气密性的方法是
装置A中反应的化学方程式为
(2)装置B、C中的药品名称分别是
(3)当反应生成SnCl4时,应熄灭
(4)老师说该实验装置E设计仍不完整,请你协助该研究小组设计出所缺装置(须标出试剂的名称,装置图尽可能简单)并在图2的方框中画出.
(5)实验制得的SnCl4中因溶解了Cl2而略显黄色.提纯SnCl4的方法是
第一步:金属Sn的制备--以锡石SnO2为原料,用足量的焦炭作还原剂,在高温下可制得粗锡,该反应的化学方程式为
SnO2+2C
Sn+2CO
| ||
SnO2+2C
Sn+2CO
.
| ||
已知锡与碳同族,粗锡经电解精炼可得纯锡,精炼时的阴极反应式为
Sn2++2eˉ=Sn
Sn2++2eˉ=Sn
.第二步:SnCl4的制备--用干燥、纯净的Cl2与熔融的Sn反应制SnCl4,同时放出大量的热.已知SnCl4常温下是无色液体,沸点114℃,遇潮湿空气便发生水解反应,Sn的熔点:231℃,如图1是制取SnCl4的实验装置.

试回答以下问题:
(1)本试验中检查制气装置A气密性的方法是
将A右端导管放人盛有水的烧杯中,微热烧瓶导管口出现气泡,冷却导管中出现一段稳定水柱
将A右端导管放人盛有水的烧杯中,微热烧瓶导管口出现气泡,冷却导管中出现一段稳定水柱
.装置A中反应的化学方程式为
MnO2+4HCl(浓)
MnCl2+Cl2↑+2H2O
| ||
MnO2+4HCl(浓)
MnCl2+Cl2↑+2H2O
.
| ||
(2)装置B、C中的药品名称分别是
饱和食盐水
饱和食盐水
、浓硫酸
浓硫酸
.(3)当反应生成SnCl4时,应熄灭
D
D
处的酒精灯,理由是依靠反应放出的热量维持SnCl4的生成
依靠反应放出的热量维持SnCl4的生成
.(4)老师说该实验装置E设计仍不完整,请你协助该研究小组设计出所缺装置(须标出试剂的名称,装置图尽可能简单)并在图2的方框中画出.
(5)实验制得的SnCl4中因溶解了Cl2而略显黄色.提纯SnCl4的方法是
蒸馏
蒸馏
.分析:根据反应物和生成物,利用质量守恒定律和写出化学方程式,应为SnO2+2C
Sn+2CO;电解精炼可得纯锡,精炼时的阴极发生还原反应生成Sn,电解精炼可得纯锡,精炼时的阴极 Sn2++2e-=Sn;
(1)检查制气装置A气密性是利用压强变化和液面变化分析判断;装置是制备氯气的发生装置,反应的原理是二氧化锰氧化浓盐酸加热反应生成氯化锰、氯气和水;
(2)氯气中含有氯化氢和水蒸气需要利用饱和食盐水和浓硫酸除去;
(3)根据题意,该反应放热,停止加热B装置,可依靠反应放出的热量维持Sn的熔化;
(4)SnCl4遇潮湿空气便发生水解反应,生成物应干燥;
(5)已知SnCl4常温下是无色液体,沸点114℃,氯气是气体,可以利用蒸馏的方法得到;
| ||
(1)检查制气装置A气密性是利用压强变化和液面变化分析判断;装置是制备氯气的发生装置,反应的原理是二氧化锰氧化浓盐酸加热反应生成氯化锰、氯气和水;
(2)氯气中含有氯化氢和水蒸气需要利用饱和食盐水和浓硫酸除去;
(3)根据题意,该反应放热,停止加热B装置,可依靠反应放出的热量维持Sn的熔化;
(4)SnCl4遇潮湿空气便发生水解反应,生成物应干燥;
(5)已知SnCl4常温下是无色液体,沸点114℃,氯气是气体,可以利用蒸馏的方法得到;
解答:解:利用质量守恒定律和写出化学方程式,应为SnO2+2C
Sn+2CO;电解精炼可得纯锡,精炼时的阴极发生还原反应生成Sn,电解精炼可得纯锡,精炼时的阴极 Sn2++2e-=Sn.故答案为:SnO2+2C
Sn+2CO;Sn2++2e-=Sn;
(1)装置A气密性是利用压强变化和液面变化分析,将A右端导管放人盛有水的烧杯中,微热烧瓶导管口出现气泡,冷却导管中出现一段稳定水柱;A为实验室制备氯气的反应,化学方程式为:MnO2+4HCl(浓)
MnCl2+Cl2↑+2H2O;
故答案为:将A右端导管放人盛有水的烧杯中,微热烧瓶导管口出现气泡,冷却导管中出现一段稳定水柱;MnO2+4HCl(浓)
MnCl2+Cl2↑+2H2;
(2)氯气中含有氯化氢和水蒸气需要利用饱和食盐水和浓硫酸除去,装置B、C中的药品名称分别是饱和食盐水除去氯化氢,浓硫酸除去水蒸气;
故答案为:饱和食盐水,浓硫酸;
(3)该反应放热,停止加热D装置,可依靠反应放出的热量维持Sn的熔化;故答案为:D;依靠反应放出的热量维持Sn的熔化;
(4)根据题意知SnCl4遇潮湿空气便发生水解反应,生成物应干燥,在装置E后应连接一个装有碱石灰的干燥管可达到目的,装置图为:
故答案为:装置E后应连接一个装有碱石灰的干燥管;装置图为: ;
;
(5)已知SnCl4常温下是无色液体,沸点114℃,氯气是气体,可以利用蒸馏的方法得到;
故答案为:蒸馏;
| ||
| ||
(1)装置A气密性是利用压强变化和液面变化分析,将A右端导管放人盛有水的烧杯中,微热烧瓶导管口出现气泡,冷却导管中出现一段稳定水柱;A为实验室制备氯气的反应,化学方程式为:MnO2+4HCl(浓)
| ||
故答案为:将A右端导管放人盛有水的烧杯中,微热烧瓶导管口出现气泡,冷却导管中出现一段稳定水柱;MnO2+4HCl(浓)
| ||
(2)氯气中含有氯化氢和水蒸气需要利用饱和食盐水和浓硫酸除去,装置B、C中的药品名称分别是饱和食盐水除去氯化氢,浓硫酸除去水蒸气;
故答案为:饱和食盐水,浓硫酸;
(3)该反应放热,停止加热D装置,可依靠反应放出的热量维持Sn的熔化;故答案为:D;依靠反应放出的热量维持Sn的熔化;
(4)根据题意知SnCl4遇潮湿空气便发生水解反应,生成物应干燥,在装置E后应连接一个装有碱石灰的干燥管可达到目的,装置图为:

故答案为:装置E后应连接一个装有碱石灰的干燥管;装置图为:
 ;
;(5)已知SnCl4常温下是无色液体,沸点114℃,氯气是气体,可以利用蒸馏的方法得到;
故答案为:蒸馏;
点评:本题考查较为综合,涉及到物质的制备、电解、除杂等问题实验方案的设计和评价.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
 SnCl4的制备需分两步进行,第一步是金属Sn的制备,第二步由Sn和Cl2反应生成SnCl4.
SnCl4的制备需分两步进行,第一步是金属Sn的制备,第二步由Sn和Cl2反应生成SnCl4.
 SnCl4的制备需分两步进行,第一步是金属Sn的制备,第二步由Sn和Cl2反应生成SnCl4.
SnCl4的制备需分两步进行,第一步是金属Sn的制备,第二步由Sn和Cl2反应生成SnCl4.