题目内容
下列各项中的两个量,其比值一定为2:1的是( )
| A、液面在“0”刻度时,50mL碱式滴定管和25mL碱式滴定管所盛液体的体积 |
| B、相同温度下,0.2mol?L-1醋酸溶液和0.1mol?L-1醋酸溶液中的c(H+) |
| C、在0.1mol?L-1NaHSO4溶液中,阳离子数与阴离子数 |
| D、在FeCl2溶液中,c(Cl-)与c(Fe2+) |
考点:弱电解质在水溶液中的电离平衡,电解质在水溶液中的电离,盐类水解的原理
专题:
分析:A.滴定管最大数值下面还有溶液,其体积未知;
B.醋酸是弱电解质溶液中存在电离平衡,浓度不同电离程度不同;
C.NaHSO4是强酸的酸式盐,完全电离;
D.在FeCl2溶液中,二价铁发生水解.
B.醋酸是弱电解质溶液中存在电离平衡,浓度不同电离程度不同;
C.NaHSO4是强酸的酸式盐,完全电离;
D.在FeCl2溶液中,二价铁发生水解.
解答:
解:A.滴定管最大值下面还有溶液,且这部分溶液的体积未知,导致无法计算其溶液体积的比值,故A错误;
B.相同温度下0.lmol/L的CH3COOH与0.2mol/L的CH3COOH溶液中,醋酸的电离程度不同,所以的c(H+)之比不是1:2,故B错误;
C.NaHSO4是强酸的酸式盐,完全电离,所以阳离子数与阴离子数之比等于2:1,故C正确;
D.在FeCl2溶液中,二价铁发生水解,所以c(Cl-)与c(Fe2+)之比大于2:1,故D错误;
故选C.
B.相同温度下0.lmol/L的CH3COOH与0.2mol/L的CH3COOH溶液中,醋酸的电离程度不同,所以的c(H+)之比不是1:2,故B错误;
C.NaHSO4是强酸的酸式盐,完全电离,所以阳离子数与阴离子数之比等于2:1,故C正确;
D.在FeCl2溶液中,二价铁发生水解,所以c(Cl-)与c(Fe2+)之比大于2:1,故D错误;
故选C.
点评:本题考查较为综合,涉及滴定管的构造,离子浓度大小比较以及弱电解质的电离等问题,综合考查学生的分析、理解能力,为高考常见题型,难度中等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
氯化银在水中存在沉淀溶解平衡,25℃时,氯化银的Ksp=1.8×10-10.现将足量氯化银分别放入:①100mL蒸馏水中;②100mL 0.1mol?L-1盐酸中;③100mL 0.1mol?L-1氯化铝溶液中,充分搅拌后,在相同温度下,c(Ag+)由大到小的顺序是( )
| A、①②③ | B、③②① |
| C、②①③ | D、②③① |
对于某合成材料(如塑料制品)废弃物的处理方法中正确的是( )
| A、将废弃物混在垃圾中填埋在土壤中 |
| B、将废弃物焚烧 |
| C、将废弃物用化学方法加工成涂料或汽油 |
| D、将废弃物倾倒在海洋中 |
有关离子浓度大小比较的判断正确的是( )
| A、常温下NaB溶液的pH=8,c(Na+)-c(B-)=1×10-2 mol/L |
| B、Na2CO3溶液中,2c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3) |
| C、KHSO3溶液呈酸性,c(K+)>c(HSO3-)>c(H+)>c(SO32-)>c(OH-) |
| D、0.1mol?L-1 NH4Cl和0.1mol?L-1 NH3?H2O等体积混合后溶液呈碱性:c(NH3?H2O)>c(Cl-)>c(NH4+)>c(OH-)>c(H+) |
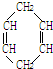 可简写为
可简写为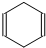 .现有某化合物W的分子结构可表示为
.现有某化合物W的分子结构可表示为 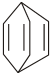 .
. 氮是地球上含量丰富的一种元素,氮元素的单质及其化合物在工农业生产、生活中有着重要作用.
氮是地球上含量丰富的一种元素,氮元素的单质及其化合物在工农业生产、生活中有着重要作用.