题目内容
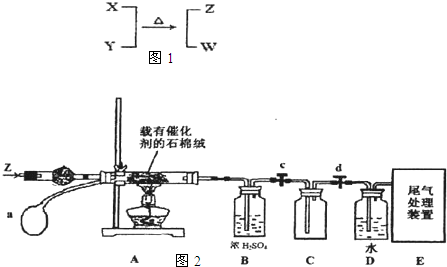
 用如图所示装置制取纯净的Fe(OH)2,下列说法不正确的是( )
用如图所示装置制取纯净的Fe(OH)2,下列说法不正确的是( )| A、a电极一定是铁,电解液c可以是CuCl2溶液 |
| B、电解一段时间,b电极附近pH升高 |
| C、溶液中的阴离子向a电极移动 |
| D、在加入苯之前应将电解液c加热煮沸 |
考点:原电池和电解池的工作原理
专题:电化学专题
分析:电解法制备Fe(OH)2 时,采用金属Fe作阳极,阳极方程式为:Fe-2e-=Fe2+;阴极材料可以是铁也可以是其它能导电的材料,阴极方程式为:2H++2e-=H2↑,因为氢离子放电破坏水的电离平衡,使氢氧根离子浓度增大,与亚铁离子结合成Fe(OH)2沉淀,加入苯,可防止氢氧化亚铁被氧化.
解答:
解:A.如电解液c是CuCl2溶液,在阴极生成铜,则不能生成OH-,不能制备氢氧化亚铁,故A错误;
B.b极发生2H++2e-=H2↑,促进水的电离生成OH-,则b电极附近pH升高,故B正确;
C.电解时,阴离子向阳极移动,故C正确;
D.在加入苯之前应将电解液c加热煮沸,可排除溶解氧,避免氢氧化亚铁被氧化,故D正确.
故选A.
B.b极发生2H++2e-=H2↑,促进水的电离生成OH-,则b电极附近pH升高,故B正确;
C.电解时,阴离子向阳极移动,故C正确;
D.在加入苯之前应将电解液c加热煮沸,可排除溶解氧,避免氢氧化亚铁被氧化,故D正确.
故选A.
点评:本题主要考查了氢氧化亚铁沉淀的制备,掌握电解池的原理及其应用是解答的关键,题目难度不大.

练习册系列答案
 新活力总动员暑系列答案
新活力总动员暑系列答案 龙人图书快乐假期暑假作业郑州大学出版社系列答案
龙人图书快乐假期暑假作业郑州大学出版社系列答案
相关题目
下列实验操作正确的是( )
| A、粗盐提纯时,为了加快过滤速率,可用玻璃棒搅拌过滤器中的液体 |
| B、容量瓶检漏:在容量瓶中注入适量的水,塞上玻璃瓶塞,左手五指托住瓶底,右手食指顶住瓶塞,反复倒置数次,观察是否漏水 |
| C、用分液法分离C2H5OH与H2O的混合物 |
| D、测定溶液pH的操作:将pH试纸置于表面皿上,用玻璃棒蘸取溶液,点在pH试纸的中部,与对应的标准比色卡比较 |
在0.1mol?L-1NH3?H2O溶液中有如下电离平衡:NH3?H2O?NH4++OH-对于该平衡,下列叙述正确的是( )
| A、加入水时,平衡向逆反应方向移动 |
| B、加入少量NaOH固体,平衡向逆反应方向移动 |
| C、加入少量 0.1mol?L-1盐酸,溶液中c(H+)减小 |
| D、加入少量NH4Cl固体,平衡向正反应方向移动 |
在CH3COONa溶液中,各微粒的浓度关系错误的是( )
| A、c(Na+)>c(CH3COO-)>c(H+)>c(OH-) |
| B、c(OH-)=c(H+)+c(CH3COOH) |
| C、c(Na+)=c(CH3COO-)+c(CH3COOH) |
| D、c(Na+)+c(H+)=c(CH3COO-)+c(OH-) |
常温下,下列各组离子在指定溶液中一定能大量共存的是( )
| A、无色溶液中:K+、Na+、Cu2+、SO42- | ||
B、
| ||
| C、由水电离出的C(OH-)=1×10-12mol?L-1的溶液:NH4+、HCO3-、Na+、Cl- | ||
| D、c(OH-)=10-13mol?L-1的溶液中:Al3+、NO3-、I-、Cl- |
设NA为阿伏加德罗常数的值,下列说法中一定正确的是( )
| A、在标准状况下,V升 SO3含氧原子个数是3VNA/22.4 |
| B、0.1molCnH2n+2中含有的C-C键数为0.1×n×NA |
| C、常温常压下,22g氧气和26g臭氧混合气体所含氧原子总数为3NA |
| D、1 mol Cl2发生反应时,转移的电子数一定是2 NA |