题目内容
1.环己酮是一种重要的有机化工原料.实验室合成环己酮的反应为: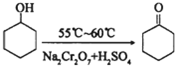
环己醇和环己酮的部分物理性质见下表:
| 物质 | 相对分子质量 | 沸点(℃) | 密度(g•cm-3、20℃) | 溶解性 |
| 环己醇 | 100 | 161.1 | 0.9624 | 能溶于水和醚 |
| 环己酮 | 98 | 155.6 | 0.9478 | 微溶于水,能溶于醚 |
a.蒸馏、除去乙醚后,收集151℃~156℃馏分
b.水层用乙醚(乙醚沸点34.6℃,易燃烧)萃取,萃取液并入有机层
c.过滤
d.往液体中加入NaCl固体至饱和,静置,分液
e.加入无水MgSO4固体,除去有机物中少量水
回答下列问题:
(1)上述分提纯步骤的正确顺序是dbeca.
(2)b中水层用乙醚萃取的目的是使水层中少量的有机物进一步被提取,提高产品的产量.
(3)从下关于萃取分液操作的叙述中,不正确的是ABC.
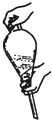
A.水溶液中加入乙醚,转移至分液漏斗,塞上玻璃塞,如图用力振荡
B.振荡几次后需打开分液漏斗上口的玻璃塞放气
C.经几次振荡并放气后,手持分漏斗静置液体分层
D.分液时,需先将上口玻璃塞打开或玻璃塞上的凹槽对准漏斗上的小孔,再打开旋塞待下层液体全部流尽时,再从上口倒出上层液体
(4)在上述操作d中,加入NaCl固体的作用是降低环己酮的溶解度;增加水层的密度,有利于分层.蒸馏除乙醚的操作中采用的加热方式为水浴加热.
(5)蒸馏操作时,一段时间后发现未通冷凝水,应采取的正确方法是停止加热,冷却后通自来水.
(6)恢复至室温时,分离得到纯产品体积为12mL,则环己酮的产率约是60%(60.3%).
分析 (1)环己酮的提纯时应首先加入NaCl固体,使水溶液的密度增大,将水与有机物更容易分离开来,然后向有机层中加入无水MgSO4,出去有机物中少量的水,然后过滤,除去硫酸镁晶体,再进行蒸馏即可;
(2)环己酮在乙醚中的溶解度大于在水中的溶解度,且乙醚和水不互溶,则乙醚能作萃取剂,从而提高产品产量;
(3)A.水溶液中加入乙醚,转移至分液漏斗,塞上玻璃塞,应该倒转过来然后用力振荡;
B.放气的方法为:漏斗倒置,打开旋塞放气;
C.经几次振摇并放气后,分液漏斗放置在铁架台上静置待液体分层;
D.分液时,需先将上口玻璃塞打开或玻璃塞上的凹槽对准漏斗上的小孔,再打开旋塞待下层液体全部流尽时,再从上口倒出上层液体;
(4)NaCl能增加水层的密度,降低环己酮的溶解,有利于分层;乙醚的沸点较低,所以蒸馏时温度不宜太高;(5)为防止冷凝管炸裂,应该停止加热;
(6)m(环己酮)=12mL×0.9478g=11.3736g,根据环己醇和环己酮的关系式知,参加反应的m(环己醇)=$\frac{11.3736g}{98g/mol}×100g/mol$=11.6057g,m(环己醇)=20mL×0.9624g/mL=19.248g,据此计算产率.
解答 解:(1)环己酮的提纯时应首先加入NaCl固体,使水溶液的密度增大,水与有机物更容易分离开,然后向有机层中加入无水MgSO4,除去有机物中少量的水,然后过滤,除去硫酸镁晶体,再进行蒸馏即可,故答案为d b e c a;
(2)环己酮在乙醚中的溶解度大于在水中的溶解度,且乙醚和水不互溶,则乙醚能作萃取剂,能将水中的环己酮萃取到乙醚中,从而提高产品产量,
故答案为:使水层中少量的有机物进一步被提取,提高产品的产量;
(3)A.水溶液中加入乙醚,转移至分液漏斗,塞上玻璃塞,应该倒转过来然后用力振荡,只有如此才能充分混合,故A错误;
B.放气的方法为:漏斗倒置,打开旋塞放气,而不是打开玻璃塞,故B错误;
C.经几次振摇并放气后,分液漏斗放置在铁架台上静置待液体分层,而不是手持分漏斗静置液体分层
,不符合操作规范性,故C错误;
D.分液时,需先将上口玻璃塞打开或玻璃塞上的凹槽对准漏斗上的小孔,利用压强差使液体流出,再打开旋塞待下层液体全部流尽时,为防止产生杂质,再从上口倒出上层液体,故D错误;
故选ABC;
(4)NaCl能增加水层的密度,降低环己酮的溶解,且有利于分层;乙醚的沸点较低,所以蒸馏时温度不宜太高,所以应该采用水浴加热,
故答案为:降低环己酮的溶解度,增加水层的密度,有利于分层;水浴加热;
(5)如果直接将冷水连接冷凝管,馏分温度如果急剧冷却会导致冷凝管炸裂,为防止冷凝管炸裂,应该停止加热,冷却后通自来水,故答案为:停止加热,冷却后通自来水;
(6)m(环己酮)=12mL×0.9478g=11.3736g,根据环己醇和环己酮的关系式知,参加反应的m(环己醇)=$\frac{11.3736g}{98g/mol}×100g/mol$=11.6057g,m(环己醇)=20mL×0.9624g/mL=19.248g,其产率=$\frac{11.6057g}{19.248g}×100%$=60%(60.3%),
故答案为:60%(60.3%).
点评 本题考查制备实验方案设计,涉及物质的分离提纯、基本实验操作、基本计算等知识点,明确实验原理是解本题关键,同时考查学生获取信息、利用信息解答问题能力,易错点是(3)中基本操作方法.

| 元素 | I1 | I2 | I3 | I4 |
| X | 500 | 4600 | 6900 | 9500 |
| Y | 580 | 1800 | 2700 | 11600 |
| A. | 元素X的常见化合价是+1 | |
| B. | 元素X与氯形成化合物时,化学式可能是XCl | |
| C. | 元素Y是ⅢA族元素 | |
| D. | 若元素Y处于第三周期,它可与冷水剧烈反应 |
| A. | 甲苯与硝酸发生取代反应生成三硝基甲苯 | |
| B. | 甲苯能使热的KMnO4酸性溶液褪色 | |
| C. | 甲苯燃烧时产生带浓烈黑烟的火焰 | |
| D. | 1 mol甲苯最多能与3 mol氢气发生加成反应 |

| A. | 香芹酮化学式为C10H14O | |
| B. | 香芹酮可以发生加成反应、消去反应和氧化反应 | |
| C. | 香芹酮能使酸性KMnO4溶液褪色 | |
| D. | 香芹酮分子中有3种官能团 |
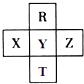 元素R、T、X、Y、Z在元素周期表中的相对位置如图所示,其中R单质在暗处与H2剧烈化合并发生爆炸,生成HR.则下列判断正确的是( )
元素R、T、X、Y、Z在元素周期表中的相对位置如图所示,其中R单质在暗处与H2剧烈化合并发生爆炸,生成HR.则下列判断正确的是( )| A. | 非金属性:Z<Y<X | |
| B. | R与Y的电子数相差8 | |
| C. | 气态氢化物稳定性:HR<HY<HT | |
| D. | 最高价氧化物的水化物的酸性:HTO4>HYO4 |
 乙酰苯胺具有退热镇痛作用,是较早使用的解热镇痛药,有“退热冰”之称.其制备原理如下:
乙酰苯胺具有退热镇痛作用,是较早使用的解热镇痛药,有“退热冰”之称.其制备原理如下: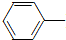 NH2+CH3COOH$\stackrel{△}{→}$
NH2+CH3COOH$\stackrel{△}{→}$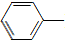 NHCOCH3+H2O
NHCOCH3+H2O已知:
①苯胺易被氧化;
②乙酰苯胺、苯胺和醋酸的部分物理性质如下表:
| 物质 | 熔点 | 沸点 | 溶解度(20℃) |
| 乙酰苯胺 | 114.3℃ | 305℃ | 0.46 |
| 苯胺 | -6℃ | 184.4 | 3.4 |
| 醋酸 | 16.6℃ | 118℃ | 易溶 |
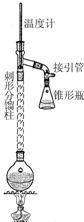
步骤1:在50mL圆底烧瓶中,加入5mL苯胺、7.5mL冰醋酸及少许锌粉,依照如图装置组装仪器.
步骤2:控制温度计示数约105℃,小火加热回流1h.
步骤3:趁热将反应混合物倒入盛有100mL冷水的烧杯中,冷却后抽滤,洗涤,得到粗产品.
请回答下列问题:
(1)步骤1中加入锌粉的作用是防止苯胺被氧化,同时起着沸石的作用.
(2)步骤2中控制温度计示数约105℃的原因是温度过高,未反应的乙酸蒸出,降低反应物的利用率,温度过低,又不能除去反应生成的水.
(3)步骤3中趁热将混合物倒入盛有冷水的烧杯中,“趁热”的原因是若让反应混合物冷却,则固体析出沾在瓶壁上不易处理.抽滤装置所包含的仪器除减压系统外还有吸滤瓶、布氏漏斗(填仪器名称).
(4)步骤3得到的粗产品需进一步提纯,该提纯方法是重结晶.
(1)用活性炭还原法处理氮氧化物.有关反应为:C(s)+2N0(g)?N2(g)+C02(g)△H.某研究小组 向某密闭容器中加人一定量的活性炭和NO,恒温(T1℃)条件下反应,反应进行到不同时间测得各物质的浓度如下.
 | NO | N2 | CO2 |
| 0 | 0.100 | 0 | 0 |
| 10 | 0.058 | 0.021 | 0.021 |
| 20 | 0.040 | 0.030 | 0.030 |
| 30 | 0.040 | 0.030 | 0.030 |
| 40 | 0.032 | 0.034 | 0.017 |
| 50 | 0.032 | 0.034 | 0.017 |
②30 min后,改变某一条件,反应重新达到平衡,则改变的条件可能是减小CO2的浓度;
③若30 min后升高温度至T2℃,达到平衡时,容器中NO、N2、CO2的浓度之比为5:3:3,则该反应的△H<0(填“>”、“=”或“<”)..
(2)用CH4催化还原氮氧化物可以消除氮氧化物的污染.已知:
①CH4(g)+4N02(g)═4NO(g)+CO2(g)+2H20(g)△H=-574 kJ•mol-1
②CH4(g)+4N0(g)═2N2(g)+C02(g)+2H20(g)△H=-1160 kJ•mol-1
③H2O(g)═H20(l)△H=-44.0 kJ.mol-1
写出CH4 (g)与NO2 (g)反应生成N2 (g)、CO2 (g)和H20(1)的热化学方程式CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(l)△H=-955kJ•mol-1
(3)新型氨法烟气脱硫技术化学原理是采用氨水吸收烟气中的SO2,再用一定量磷酸与上述吸收产物反应.该技术优点除了能回收利用S02外,还能得到一种复合肥料.
①该复合肥料可能的化学式为(NH4)3PO4、(NH4)2HPO4、NH4H2PO4(写出一种即可).
②若氨水与SO2恰好完全反应生成正盐,则此时溶液呈碱性(填“酸”或“碱”).
(已知常温下:氨水 Kb=1.8×10-5 mol•L-1,H2SO4 Ka1=1.3×10-2 mol•L-1,Ka2=6.
 3×10-8mol•L-1)
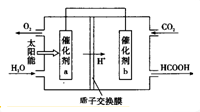
3×10-8mol•L-1)(4)将燃煤产生的二氧化碳回收利用,可达到低碳排放的目的.如图是通过人工光合作用,以CO2和H20为原料制备HCOOH和02的原理示意图.催化剂b表面发生的电极反应式为CO2+2H++2e-=HCOOH.常温下,0.1 mol/L的HCOONa溶液pH为10,则HCOOH的电离常数Ka=10-7.
| A. | N | B. | Ni | C. | Cr | D. | Cu+ |
 .
.