题目内容
0.1mol/L CH3COOH,HCl,H2SO4各50mL,PH从大到小排列为 .
考点:pH的简单计算,弱电解质在水溶液中的电离平衡
专题:电离平衡与溶液的pH专题
分析:0.1mol/L CH3COOH,HCl,H2SO4各50mL,溶液中氢离子浓度<0.1mol/L,HCl中氢离子能否=0.1mol/L,H2SO4中氢离子浓度=0.2mol/L,溶液PH依据氢离子浓度的负对数计算,氢离子浓度越大,PH越小.
解答:
解:0.1mol/L CH3COOH,HCl,H2SO4各50mL,溶液中氢离子浓度<0.1mol/L,HCl中氢离子能否=0.1mol/L,H2SO4中氢离子浓度=0.2mol/L,溶液PH依据氢离子浓度的负对数计算,氢离子浓度越大,PH越小,PH从大到小排列为:CH3COOH>HCl>H2SO4;
故答案为:CH3COOH>HCl>H2SO4.
故答案为:CH3COOH>HCl>H2SO4.
点评:本题考查了溶液中氢离子浓度大小的分析计算,掌握基础是关键,题目较简单.

练习册系列答案
相关题目
下列说法正确的是( )
| A、中和热一定是强酸跟强碱反应放出的热量 |
| B、1 mol酸与1 mol碱完全反应放出的热量是中和热 |
| C、在稀溶液中,酸与碱发生中和反应生成1 mol H2O(l)时的反应热叫做中和热 |
| D、测定中和热时可用稀硫酸和稀Ba(OH)2溶液 |
下列说法中正确的是( )
| A、所有主族元素中,氟的电负性最大 |
| B、钠的第一电离能比镁的第一电离能大 |
| C、第三周期所包含的元素中钠的原子半径最小 |
| D、电子云示意图中的每个小黑点都表示一个电子 |
CS2(液)能在氧气中完全燃烧,生成CO2和SO2,若用0.1molCS2在1molO2中完全燃烧后,反应后混合物在标准状况下所占的体积为( )
| A、6.72L |
| B、13.44L |
| C、15.68L |
| D、22.4L |
下列物质的分离提纯主要是利用化学性质的是( )
| A、沙里淘金 |
| B、利用磁铁分离铁屑和沙混合物 |
| C、利用自来水制备蒸馏水 |
| D、粗盐提纯中除去粗盐含有的可溶性杂质 |
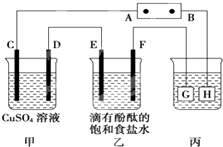 如图装置所示,C、D、E、F都是惰性电极,甲、乙中溶液的体积和浓度都相同(假设通电前后溶液体积不变),A、B为外接直流电源的两极.将直流电源接通后,F极附近呈红色.
如图装置所示,C、D、E、F都是惰性电极,甲、乙中溶液的体积和浓度都相同(假设通电前后溶液体积不变),A、B为外接直流电源的两极.将直流电源接通后,F极附近呈红色.