题目内容
8.2015年CES消费电子展开幕前夕,丰田汽车公司宣布将会开放氢燃料电池技术专利的使用权,并正式发布量产型氢燃料电池轿车Mirai.氢氧燃料电池是符合绿色化学理念的新型发电装置.如图3为电池示意图,该电池电极表面镀一层细小的铂粉,铂吸附气体的能力强,性质稳定.
(1)该电池的负极反应式为H2-2e-+2OH-=2H2O
(2)氢气的制备和存储是氢氧燃料电池能否有效推广的关键技术.有人提出利用光伏发电装置电解尿素的碱性溶液来制备氢气.光伏发电是当今世界利用太阳能最主要方式之一.图1为光伏并网发电装置,图2为电解尿素[CO(NH2)2](C为+4价)的碱性溶液制氢的装置示意图(电解池中隔膜仅阻止气体通过,阴、阳极均为惰性电极).
①图1中N型半导体为负极(“正极”或“负极”)
②该系统工作时,A极的电极反应式为CO(NH2)2+80H--6e-═CO32-+N2↑+6H2O
③若A极产生7.00g N2,则此时B极产生16.8L H2(标况下).
分析 (1)该电池的负极是氢气在碱性条件下发生氧化反应;
(2)该电池反应时中,氮元素化合价由-3价变为0价,H元素化合价由+1价变为0价,所以生成氮气的电极A是阳极,生成氢气的电极B是阴极,结合电解池的工作原理分析解答.
解答 解:(1)该电池的负极是氢气在碱性条件下发生氧化反应,电极反应式为:H2-2e-+2OH-=2H2O,故答案为:H2-2e-+2OH-=2H2O;
(2)①该电池反应时中,氮元素化合价由-3价变为0价,H元素化合价由+1价变为0价,则氮元素被氧化,氢元素被还原,所以生成氮气的电极A是阳极,生成氢气的电极B是阴极,则图1中N型半导体为负极,P型半导体为正极,故答案为:负极;
②A极为阳极,发生氧化反应,电极反应式为:CO(NH2)2+80H--6e-═CO32-+N2↑+6H2O,故答案为:CO(NH2)2+80H--6e-═CO32-+N2↑+6H2O;
③若A极产生7.00g N2,氮气的物质的量为:$\frac{7g}{28g/mol}$=0.25mol,转移电子的物质的量为:0.25mol×6=1.5mol,所以生成氢气的物质的量为:$\frac{1.5}{2}$mol=0.75mol,则体积为:0.75mol×22.4L/mol=16.8L,故答案为:16.8.
点评 本题考查了电解原理,明确元素化合价变化与阴阳极的关系是解本题关键,根据电解池的工作原理来分析解答,难度中等.

练习册系列答案
相关题目
19.若不断地升高温度,实现“水→水蒸气→氧气和氢气→氧原子和氢原子”的变化.在变化的各阶段被破坏的粒子间的主要相互作用依次是( )
| A. | 氢键;分子间作用力;非极性键 | B. | 氢键;极性键;分子间作用力 | ||
| C. | 氢键;极性键; 非极性键 | D. | 分子间作用力;氢键;非极性键 |
16.某学生将溴乙烷与NaOH溶液共热几分钟后,冷却,滴入AgNO3溶液,结果未见到浅黄色沉淀生成,其主要原因是( )
| A. | 加热时间太短 | B. | 不应冷却后再加入AgNO3 | ||
| C. | 加AgNO3溶液前未用稀HNO3酸化 | D. | 反应后的溶液中不存在Br- |
13.将锌片和铜片用导线连接置于稀硫酸溶液中,下列各叙述错误的是( )
| A. | 铜片作正极 | B. | 正极反应为:2H++2e-═H2↑ | ||
| C. | 溶液中的H+移向正极 | D. | 锌片作负极,锌发生还原反应 |
20. 图为实验室制取某有机物的装置图,试通过已学知识回答下列问题:
图为实验室制取某有机物的装置图,试通过已学知识回答下列问题:
(1)写出该反应的化学方程式 .
.
(2)试管上方的长导管的作用是冷凝回流.
(3)该实验中加入试剂的先后顺序为苯、硝酸、浓硫酸(填试剂名称)
 图为实验室制取某有机物的装置图,试通过已学知识回答下列问题:
图为实验室制取某有机物的装置图,试通过已学知识回答下列问题:(1)写出该反应的化学方程式
 .
.(2)试管上方的长导管的作用是冷凝回流.
(3)该实验中加入试剂的先后顺序为苯、硝酸、浓硫酸(填试剂名称)
17.下列说法错误的是( )
| A. | 乙醇的分子式为C2H5OH | B. | 乙酸乙酯难溶于水 | ||
| C. | 乙醇可用作燃料 | D. | 加热可以使蛋白质变性 |
18.关于如图所示装置的叙述中,正确的是( )
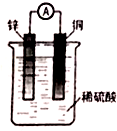

| A. | 铜片为电池的负极 | B. | 该装置将电能转化为化学能 | ||
| C. | 锌片的反应为Zn-2e-═Zn 2+ | D. | 电子由铜片经由导线流向锌片 |