��Ŀ����
����Ŀ�����ð�Һ������ӡˢп��ʱ����ϡ���ḯʴп���õ��ġ���Һ��(����������Cl����Fe3��)��ij��ѧ��ȤС�����á��ð�Һ����ȡZn(NO3)2��6H2O�Ĺ������£�

��֪��Zn(NO3)2��6H2O��һ����ɫ���壬ˮ��Һ�����ԣ�Zn(NO3)2����Ӧ���õ��IJ���������ԡ�
��1�����ð�Һ�������ʵ���Ҫ�ɷ���______(�ѧʽ����ͬ)��
��2�����������Ҫ�ɷ���____________��
��3���������м�����е�Ŀ����_____________���˲�����������������_______________��
��4�������ܱ���pH��2��Ŀ����____________��
���𰸡���1��Zn(NO3)2 ��2��Zn(OH)2��Fe(OH)3
��3����ʹFe3����ȫˮ�� �¶�Խ����ˮ��̶�Խ�� ��4������Zn2��ˮ��ΪZn(OH)2
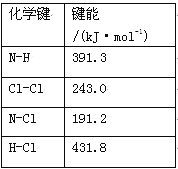
��������
������������ð�Һ���к��д�����п���ӡ������ӡ���������Ӻ�������Cl����Fe3+�������������Ƶ�����Һ��PH=8ʹ�����ӡ�п������ȫ������Ȼ���ڳ������м������ܽ⣬��Һ���к��д���п���ӡ������ӡ���������Ӻ������������ӣ�������Һ��PHʹ�����ӳ�������Һ��������п��Һ�������������¼���Ũ�������ᾧ���õ�Zn��NO3��26H2O��һ����ɫ���壮��1���ð�Һ�������ʵ���Ҫ�ɷ���Zn��NO3��2��
��2�������������ƣ�Zn2+��Fe3+��ȫ����������Ӧ����������ʴ�Ϊ��Fe��OH��3��Zn��OH��2��
��3������д�ʹFe3+��ȫˮ�⣬ԭ�����¶�Խ�ߣ�ˮ��̶�Խ�ʴ�Ϊ���ٽ�Fe3+��ȫˮ�⣻ˮ�ⷴӦ���ȣ��¶ȸߣ�ˮ��̶ȴ�
��4��п������ˮ������������п�����������¿�����п���ӵ�ˮ�⣬������ܱ���pH=2��Ŀ��������Zn2+ˮ��ΪZn��OH��2��

 ����������ϵ�д�
����������ϵ�д�����Ŀ����A��B��C��D��E����Ԫ�ء��������Ϣ���£�
Ԫ�� | �����Ϣ |
A | AԪ�ص�һ��ԭ��û�����ӣ�ֻ��һ������ |
B | B�ǵ縺������Ԫ�� |
C | C�Ļ�̬ԭ��2p���������δ�ɶԵ��� |
D | DΪ����Ԫ�أ�����Eͬ���ڣ�����������������˶�״̬��ͬ�ĵ��� |
E | E���γ�ש��ɫ����ɫ����E2O��EO���������� |
�ش��������⡣
��1��д��EԪ��ԭ�ӻ�̬ʱM��ĵ����Ų�ʽ ��
��2��CԪ�ص��ʷ����к������������ļ���֮��Ϊ ��
��3��������ˮ�е��ܽ��C7H15OH���Ҵ��͵�ԭ���ǣ� ��
��4��A��C��E����Ԫ�ؿ��γɣ�E��CA3��42+�����ӣ����д��ڵĻ�ѧ�������� ������ţ���
����λ�� �������� �����Թ��ۼ� ���Ǽ��Թ��ۼ� �����Ӽ� �����
�� E��CA3��42+���жԳƵĿռ乹�ͣ��ҵ� E��CA3��42+�е�����CA3���ӱ�����Clȡ��ʱ���ܵõ����ֲ�ͬ�ṹ�IJ���� E��CA3��42+�Ŀռ乹��Ϊ ������ţ���
a��ƽ�������� b���������� c�������� d��V��
��5�����������ǻ���ɫ��״�ᾧ����ṹ��ͼ��ʾ��

������������Pԭ�Ӳ�ȡ____�ӻ�����PO3����Ϊ�ȵ�����Ļ�������ӵĻ�ѧʽΪ________����NA��ʾ�����ӵ���������ֵ��0��1mol�����������к��еŵ��Ӷ���Ϊ_________��