题目内容
4.下列有关晶体的说法中一定正确的是①原子晶体中只存在非极性共价键;②稀有气体形成的晶体属于原子晶体;③SO2与S都属于分子晶体,且SO2的摩尔质量比S的摩尔质量大,所以SO2熔沸点高于S;④MgCO3与CaCO3都是离子晶体,且Mg2+半径比Ca2+半径小所以MgCO3的分解温度更高;⑤分子晶体的堆积均为分子密堆积;⑥金属晶体和离子晶体都能导电;⑦离子晶体和金属晶体中均存在阳离子,但金属晶体中却不存在离子键;⑧依据构成粒子的堆积方式可将晶体分为金属晶体、离子晶体、分子晶体、原子晶体( )
| A. | ①③⑦ | B. | 只有⑦ | C. | ②④⑤⑦ | D. | ⑤⑥⑧ |
分析 ①原子晶体是原子之间通过共价键形成的晶体,同种原子之间形成的共价键是非极性键,不同元素形成的共价键是极性键,二氧化硅是原子晶体,晶体中存在极性键;
②稀有气体是单原子分子,可以形成分子晶体;
③二氧化硫常温下是气体,而硫是固体;
④Mg2+半径小于Ca2+半径,固MgO晶格能大于CaO晶格能,所以Mg2+比Ca2+更易与碳酸根离子中的氧离子结合,使碳酸根离子分解为CO2;
⑤分子晶体的堆积一般为分子密堆积,但有氢键时,配位数改变;
⑥离子晶体固态时不导电;
⑦离子晶体由阴、阳离子通过离子键形成,金属晶体是金属离子与自由电子通过金属键形成;
⑧依据构成微粒与微粒间的作用可将晶体分为金属晶体、离子晶体、分子晶体、原子晶体.
解答 解:①二氧化硅是原子晶体,晶体中存在极性键,故错误;
②稀有气体是单原子分子,可以形成分子晶体,故错误;
③二氧化硫常温下是气体,而硫是固体,所以SO2熔沸点低于S,故错误;
④Mg2+半径小于Ca2+半径,固MgO晶格能大于CaO晶格能,所以Mg2+比Ca2+更易与碳酸根离子中的氧离子结合,使碳酸根离子分解为CO2,所以碳酸钙比分解温度比碳酸镁的温度高,故错误;
⑤分子晶体的堆积一般为分子密堆积,但有氢键时,配位数改变,如由于氢键的作用,每个水分子周围只有四个紧邻的水分子,故错误;
⑥离子晶体固态时不导电,如氯化钠固体不导电,故错误;
⑦离子晶体由阴、阳离子通过离子键形成,金属晶体是金属离子与自由电子通过金属键形成,不存在离子键,故正确;
⑧依据构成微粒与微粒间的作用可将晶体分为金属晶体、离子晶体、分子晶体、原子晶体,故错误.
故选B.
点评 本题考查晶体类型与结构、化学键等,难度不大,注意稀有气体是单原子分子,不存在化学键,形成分子晶体.

练习册系列答案
 全能测控期末小状元系列答案
全能测控期末小状元系列答案
相关题目
14.下列物质中互为同分异构体的是( )
| A. | 12C与14C | B. | CH3CH2OH与CH3COOH | ||
| C. | 甲烷与丙烷 | D. | CH3CH2CH2CH3与CH3CH(CH3)2 |
15.如表是元素周期表一部分,列出了十种元素在周期表中的位置:
请用化学用语回答下列问题
(1)在③~⑦元素中,原子半径最大的是Ca(填元素符号);
(2)①~⑩中元素最高价氧化物对应的水化物中酸性最强的是HClO4(填物质化学式),呈两性的氢氧化物是Al(OH)3(填物质化学式);
(3)⑦元素的最高价氧化物对应水化物与其氢化物能生成盐M,M中含有的化学键类型有离子键、共价键;
(4)用电子式表示元素③与⑧形成化合物的过程 .
.
(5)写出⑤与NaOH反应的离子方程式:2Al+2OH-+2H2O═2AlO2-+3H2↑.
(6)写出工业冶炼⑤的化学方程式:2Al2O3$\frac{\underline{\;\;\;电解\;\;\;}}{冰晶石}$4Al+3O2↑
(7)写出将⑨元素单质从海水中(离子形式存在)提取所涉及到的三个步骤的离子方程式,第一步:Cl2+2Br-=2Cl-+Br2第二步:Br2+SO2+2H2O=4H++SO42-+2Br-; 第三步Cl2+2Br-=2Cl-+Br2.
| 族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
| 2 | ⑥ | ⑦ | ||||||
| 3 | ① | ③ | ⑤ | ⑧ | ⑩ | |||
| 4 | ② | ④ | ⑨ |
(1)在③~⑦元素中,原子半径最大的是Ca(填元素符号);
(2)①~⑩中元素最高价氧化物对应的水化物中酸性最强的是HClO4(填物质化学式),呈两性的氢氧化物是Al(OH)3(填物质化学式);
(3)⑦元素的最高价氧化物对应水化物与其氢化物能生成盐M,M中含有的化学键类型有离子键、共价键;
(4)用电子式表示元素③与⑧形成化合物的过程
 .
.(5)写出⑤与NaOH反应的离子方程式:2Al+2OH-+2H2O═2AlO2-+3H2↑.
(6)写出工业冶炼⑤的化学方程式:2Al2O3$\frac{\underline{\;\;\;电解\;\;\;}}{冰晶石}$4Al+3O2↑
(7)写出将⑨元素单质从海水中(离子形式存在)提取所涉及到的三个步骤的离子方程式,第一步:Cl2+2Br-=2Cl-+Br2第二步:Br2+SO2+2H2O=4H++SO42-+2Br-; 第三步Cl2+2Br-=2Cl-+Br2.
12.生活中常见的聚酯纤维(的确良)的结构简式如图所示: .它是由乙烯和对二甲苯经过一系列反应后的产物缩聚而成的,则合成过程中乙烯与对二甲苯的物质的量之比为( )
.它是由乙烯和对二甲苯经过一系列反应后的产物缩聚而成的,则合成过程中乙烯与对二甲苯的物质的量之比为( )
 .它是由乙烯和对二甲苯经过一系列反应后的产物缩聚而成的,则合成过程中乙烯与对二甲苯的物质的量之比为( )
.它是由乙烯和对二甲苯经过一系列反应后的产物缩聚而成的,则合成过程中乙烯与对二甲苯的物质的量之比为( )| A. | 1:1 | B. | 2:1 | C. | 1:2 | D. | 3:1 |
19.下列反应中,属于取代反应的是( )
| A. | CH2═CH2+HCl$\stackrel{一定条件}{→}$CH3CH2Cl | B. | CH4+Cl2$\stackrel{光照}{→}$CH3Cl+HCl | ||
| C. | C2H4+3O2$\stackrel{点燃}{→}$2CO2+2H2O | D. |  |
9.为了除去酸性氯化铝溶液中的Cu2+,下列实验步骤顺序和所用试剂都正确的是( )
①通过量CO2;②加盐酸;③加过量NaOH溶液;④加AlCl3; ⑤过滤.
①通过量CO2;②加盐酸;③加过量NaOH溶液;④加AlCl3; ⑤过滤.
| A. | ③⑤④⑤② | B. | ③⑤② | C. | ③⑤①② | D. | ③⑤①⑤② |
16.下列反应中,原子利用率最高的是( )
| A. | CH4+Cl2$\stackrel{光}{→}$CH3Cl+HCl | |
| B. | 乙烯的燃烧:CH2=CH2+3O2$\stackrel{点燃}{→}$ 2CO2+2H2O | |
| C. | Fe2O3+6HCl═2FeCl3+3H2O | |
| D. | Na2CO3+H2O+CO2═2NaHCO3 |
13.下列属于取代反应的是( )
| A. | 光照射甲烷与氯气的混合气体 | B. | 甲烷在氧气中燃烧 | ||
| C. | 乙烯通入溴水 | D. | 乙烯生成聚乙烯 |
14.下列表示物质组成和结构的化学用语正确的是( )
| A. | 乙烯的结构简式为:CH2CH2 | B. | H2O的电子式: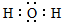 | ||
| C. | 葡萄糖的分子式:C12H22O11 | D. | 14C的原子结构示意图: |