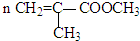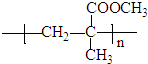题目内容
下列离子中:Na+、Mg2+、Cu2+、Fe2+、Fe3+、Al3+
(1)氧化性最强的是 ,最弱的是 .
(2)水溶液呈现颜色的是 .
(3)加入过量氨水产生白色沉淀的是 .
(4)加入过量氢氧化钠溶液产生白色沉淀的是 .
(5)加入过量氢氧化钠溶液能产生有颜色(白色除外)沉淀的是 .
(1)氧化性最强的是
(2)水溶液呈现颜色的是
(3)加入过量氨水产生白色沉淀的是
(4)加入过量氢氧化钠溶液产生白色沉淀的是
(5)加入过量氢氧化钠溶液能产生有颜色(白色除外)沉淀的是
考点:常见离子的检验方法
专题:离子反应专题
分析:(1)金属性越弱,其最高价态的离子氧化性最强,金属性越强,其最高价态的离子氧化性最弱;
(2)Cu2+、Fe2+、Fe3+分别呈现蓝色、浅绿色、棕黄色;
(3)弱碱阳离子均与氨水生成沉淀,其中铁盐、亚铁盐、铜盐有颜色;
(4)镁的强氧化物为白色,氢氧化铝具有两性;
(5)铜盐、亚铁盐、铁盐有颜色.
(2)Cu2+、Fe2+、Fe3+分别呈现蓝色、浅绿色、棕黄色;
(3)弱碱阳离子均与氨水生成沉淀,其中铁盐、亚铁盐、铜盐有颜色;
(4)镁的强氧化物为白色,氢氧化铝具有两性;
(5)铜盐、亚铁盐、铁盐有颜色.
解答:
解:(1)金属性越弱,其最高价态的离子氧化性最强,故氧化性最强的是:Fe3+;金属性越强,其最高价态的离子氧化性最弱,故最弱的是:Na+,
故答案为:Fe3+;Na+;
(2)Cu2+、Fe2+、Fe3+分别呈现蓝色、浅绿色、棕黄色,故答案为:Cu2+、Fe2+、Fe3+;
(3)弱碱阳离子均与氨水生成沉淀,其中铁盐、亚铁盐、铜盐有颜色,Mg2+、Al3+ 生成白色沉淀,故答案为:Mg2+、Al3+;
(4)镁的氢氧化物为白色,氢氧化铝具有两性,故溶于氢氧化钠溶液,故答案为:Mg2+;
(5)铜盐、亚铁盐、铁盐有颜色,分别是蓝色、白色迅速转化为灰绿色,最后红褐色,红褐色,故答案为:Cu2+、Fe2+、Fe3+.
故答案为:Fe3+;Na+;
(2)Cu2+、Fe2+、Fe3+分别呈现蓝色、浅绿色、棕黄色,故答案为:Cu2+、Fe2+、Fe3+;
(3)弱碱阳离子均与氨水生成沉淀,其中铁盐、亚铁盐、铜盐有颜色,Mg2+、Al3+ 生成白色沉淀,故答案为:Mg2+、Al3+;
(4)镁的氢氧化物为白色,氢氧化铝具有两性,故溶于氢氧化钠溶液,故答案为:Mg2+;
(5)铜盐、亚铁盐、铁盐有颜色,分别是蓝色、白色迅速转化为灰绿色,最后红褐色,红褐色,故答案为:Cu2+、Fe2+、Fe3+.
点评:本题主要考查的是常见阳离子性质与检验,熟练掌握有颜色的离子以及生成沉淀的颜色是解决本题的关键,注意铝化合物两性的考查.

练习册系列答案
相关题目
下列实验操作或结论正确的是( )
| A、用铂丝蘸取某溶液,在酒精灯火焰上灼烧,透过蓝色钴玻璃观察到火焰颜色为紫色,说明原溶液中只含有钾离子 |
| B、SO2和Cl2等物质的量混合后同时通入装有湿润的有色布条的集气瓶中,漂白效果更好 |
| C、实验室配制950毫升0.2摩尔每升的CuSO4溶液时,需称取胆矾的质量为50克 |
| D、制备Fe(OH)3胶体时,将饱和的FeCl3溶液滴入沸水中,在加热的同时不断搅拌,直到得到红褐色溶液 |
下列化学反应对应的离子方程式正确的是( )
| A、Na2S溶液使酚酞试液变红:S2-+2H2O═2OH-+H2S |
| B、在醋酸溶液中加入Na2CO3溶液:CO32-+2H+=CO2↑+H2O |
| C、碳酸氢铵溶液和足量氢氧化钠溶液混合:NH4++OH+=NH3?H2O |
| D、氯化铝溶液中加入过量氨水:Al3++3NH3?H2O=Al(OH)3↓+3NH4+ |

 将溶液(或气体)X逐渐加入(或通入)到一定量的Y溶液中,产生沉淀(或气体)的物质的量与加入X的物质的量关系如图所示,符合图中情况的一组物质是( )
将溶液(或气体)X逐渐加入(或通入)到一定量的Y溶液中,产生沉淀(或气体)的物质的量与加入X的物质的量关系如图所示,符合图中情况的一组物质是( )