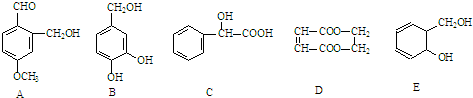
题目内容
17.写出下列离子方程式:(1)向澄清石灰水中加入过量的NaHCO3溶液.Ca2++2OH-+2HCO3-=CaCO3↓+CO32-+2H2O
(2)向NaHCO3溶液中加入过量的澄清石灰水.Ca2++HCO3-+OH-=CaCO3↓+H2O.
分析 (1)碳酸氢钠过量,氢氧化钙完全反应,碳酸根离子有剩余;
(2)氢氧化钙过量,碳酸氢根离子完全转化成碳酸钙沉淀,钙离子有剩余.
解答 解:(1)向澄清石灰水中加入过量的NaHCO3溶液,反应才碳酸钙沉淀、碳酸钠和水,反应的化学方程式是:
Ca(OH)2+2NaHCO3=CaCO3↓+Na2CO3+2H2O,反应的离子方程式为:Ca2++2OH-+2HCO3-=CaCO3↓+CO32-+2H2O,
故答案为:Ca2++2OH-+2HCO3-=CaCO3↓+CO32-+2H2O;
(2)向NaHCO3溶液中加入过量的澄清石灰水,反应生成氢氧化钠、水和碳酸钙沉淀,反应的化学方程式为:
Ca(OH)2+NaHCO3=CaCO3↓+NaOH+H2O,反应的离子方程式为:Ca2++HCO3-+OH-=CaCO3↓+H2O,
故答案为:Ca2++HCO3-+OH-=CaCO3↓+H2O.
点评 本题考查了离子方程式的书写,题目难度中等,明确反应物过量情况对生成物的影响为解答关键,注意掌握离子方程式的书写原则,试题培养了学生的分析、理解能力灵活应用基础知识的能力.

练习册系列答案
相关题目
7.二氟二氯甲烷(CF2Cl2)是甲烷的一种取代物,下列关于它的说法正确的是( )
| A. | 它有四种同分异构体 | B. | 它有两种同分异构体 | ||
| C. | 它只有一种结构 | D. | 它是平面分子 |
8.不溶于水,且密度小于水的是( )
| A. | 苯 | B. | 乙酸 | C. | 四氯化碳 | D. | 酒精 |
12.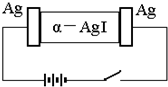 α-AgI是一种固体导体,导电率很高.为研究α-AgI到底是Ag+导电还是I-导电,设计了如下实验,下列有关结论正确的是( )
α-AgI是一种固体导体,导电率很高.为研究α-AgI到底是Ag+导电还是I-导电,设计了如下实验,下列有关结论正确的是( )
 α-AgI是一种固体导体,导电率很高.为研究α-AgI到底是Ag+导电还是I-导电,设计了如下实验,下列有关结论正确的是( )
α-AgI是一种固体导体,导电率很高.为研究α-AgI到底是Ag+导电还是I-导电,设计了如下实验,下列有关结论正确的是( )| A. | 若α-AgI是Ag+导电则通电一段时间后晶体密度不均匀 | |
| B. | 若α-AgI是Ag+导电则通电一段时间后晶体密度可能均匀 | |
| C. | 若α-AgI是I-导电则通电一段时间后晶体密度不均匀 | |
| D. | 若α-AgI是I-导电则通电一段时间后晶体密度仍均匀 |
15.下列元素中,最高正化合价最大的是( )
| A. | C | B. | F | C. | S | D. | Ne |
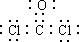 .为了防止发生事故,使用前要先检验氯仿是否变质,写出检验所用的试剂硝酸银溶液.
.为了防止发生事故,使用前要先检验氯仿是否变质,写出检验所用的试剂硝酸银溶液. .
.