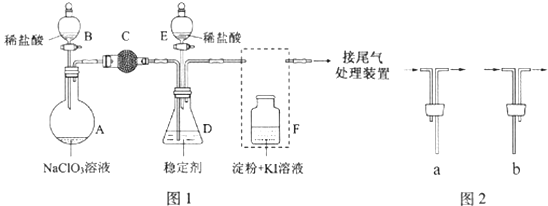
��Ŀ����
����Ŀ����������0.1molL��1������ҺNaOH��NH3H2O��HCl��CH3COOH
��1����֪CH3COOH��Һ��pH=3��������Ϊ �� ��ˮ�����c��H+��=molL��1 ��
��2����ͬpH��CH3COOH��Һ��HCl��Һ��ˮϡ�ͣ���pH�仯�����ͼ�����б�ʾHCl��Һ�������� �� a��b�����У�����������ǿ���� �� 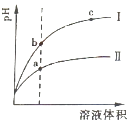
��3��NH3H2O��Һ��HCl��Һ��ϣ���֪���V��NH3H2O����V��HCl��������Һ��c��NH3H2O��=c��NH4+��ʱ����Һ��pH= �� [��֪��Kb��NH3H2O��=1.77��10��5 �� lg 1.77=0.25]��
���𰸡�
��1��1%��10��11
��2��I��a
��3��9.25
���������⣺��1����CH3COOHCH3COO��+H+֪��c��H+�������Ѿ������c��CH3COOH���������Ѿ�����Ĵ���Ũ����1.0��10��3mol/L�� ���Ԧ�= ![]() ��100%=
��100%= ![]() ��100%=1%��pH=3�Ĵ�����Һ�У�c��OH����=
��100%=1%��pH=3�Ĵ�����Һ�У�c��OH����= ![]() =10��11mol/L��������Һ������������ȫ����ˮ���룬����ˮ����������ӵ���ˮ��������������ӣ�����ˮ�����c��H+��=10��11molL��1 �� ��
=10��11mol/L��������Һ������������ȫ����ˮ���룬����ˮ����������ӵ���ˮ��������������ӣ�����ˮ�����c��H+��=10��11molL��1 �� ��
���Դ��ǣ�1%��10��11����2��pH��ȵĴ���������У���ˮϡ�ʹٽ�������룬ϡ����ͬ�ı���������������Ũ�ȴ������ᣬ����pH�仯���Ϊǿ�ᣬ����ͼ��֪��IΪ���
��Һ�ĵ�������������Ũ�ȳ����ȣ�������Ũ��Խ����Һ��pHԽС��������Һ���������ϴ����a��
���Դ��ǣ���a����3����֪Kb��NH3H2O��= ![]() =1.77��10��5 �� ����Ϊc��NH3H2O��=c��NH4+������c��OH����=1.77��10��5 �� ����c��H+��=
=1.77��10��5 �� ����Ϊc��NH3H2O��=c��NH4+������c��OH����=1.77��10��5 �� ����c��H+��= ![]() ����pH=9.25��
����pH=9.25��
���Դ��ǣ�9.25��

����Ŀ��ij�о���ѧϰС��ͬѧ����NaHCO3��KHCO3��ɵ�ij���Ȼ�������ʵ�飬����������ݣ���������ʵ���Ũ����ȣ�
50mL���� | 50mL���� | 50mL���� | |
m������ | 9.2g | 15.7g | 27.6g |
V��CO2��������� | 2.24L | 3.36L | 3.36L |
�Լ��㣺
��1������������ᷴӦ�����ӷ���ʽ
��2����������ʵ���Ũ�ȣ�
��3��������������ʵ����ʵ���֮�ȣ�
����Ŀ������ƽ�ⳣ���Ǻ���������ʵ���̶�ǿ����������֪������ݣ�
��ѧʽ | ����ƽ�ⳣ����25�棩 |
HCN | K=4.9��10��10 |
CH3COOH | K=1.8��10��5 |
H2CO3 | K1=4.3��10��7��K2=5.6��10��11 |
��1��25��ʱ���е�Ũ�ȵ�NaCN��Һ��Na2CO3��Һ��CH3COONa��Һ��������Һ��pH�ɴ�С��˳��Ϊ ��
��2��25��ʱ��pH=3��CH3COOH��Һ��pH=11��NaOH��Һ��ϣ���������Һ�����ԣ���c��Na+��c��CH3COO���������������������=������
��3��NaCN��Һ��ͨ������CO2 �� ��������Ӧ�Ļ�ѧ����ʽΪ
��4��25��ʱ��pH=8��CH3COONa��Һ�У�c��Na+����c��CH3COO����= ��