题目内容
12.化学反应原理在科研和生产中有广泛应用.Ⅰ、利用“化学蒸气转移法”制备TaS2晶体,发生如下反应:
TaS2(s)+2I2(g)═TaI4(g)+S2(g)△H>0 ( I)
(1)反应( I)的平衡常数表达式K=$\frac{c(Ta{I}_{4})c({S}_{2})}{{c}^{2}({I}_{2})}$,
(2)若K=1,向某恒容密闭容器中加入1mol I2(g)和足量TaS2(s),I2(g)的平衡转化率为66.7%.
Ⅱ、恒温下,在容积为2L的恒容密闭容器A中通入1mol N2与1mol H2的混合气体,发生如下反应:N2 (g)+3H2(g)?2NH3(g),△H<0,一段时间后,达到平衡,若平衡时氨气的物质的量为0.4mol.
(1)此温度时该反应的K值为12.5.
(2)若在此温度下,向另一容积为1L的恒容容器B中按物质的量分别为2mol、1mol、1mol充入N2、H2、NH3,此时,该反应是否处于平衡状态否(填“是”或“否”),此时若没有达平衡,反应向正方向进行(填“正”或“逆”).
分析 Ⅰ、(1)化学平衡常数等于各生成物平衡浓度系数次幂之积和各反应物平衡浓度系数次幂之积的比值;
(2)根据化学平衡常数结合转化率等于变化量和初始量的比值来计算;
Ⅱ、(1)根据三行式结合K=$\frac{{c}^{2}(N{H}_{3})}{c({N}_{2})•{c}^{3}({H}_{2})}$来计算即可;
(2)根据浓度商Qc和K的关系确定反应是否达到平衡以及反应的方向.
解答 解:Ⅰ、(1)根据题意反应(Ⅰ)的平衡常数表达式K=$\frac{c(Ta{I}_{4})c({S}_{2})}{{c}^{2}({I}_{2})}$,故答案为:K=$\frac{c(Ta{I}_{4})c({S}_{2})}{{c}^{2}({I}_{2})}$;
(2)若K=1,设 I2的平衡转化率为x,则参加反应的为xmol,平衡时生成TaI4和S2各0.5xmol,剩余I2为(1-x)mol,
根据K=$\frac{c(Ta{I}_{4})c({S}_{2})}{{c}^{2}({I}_{2})}$=$\frac{0.5x×0.5x}{(1-x)^{2}}$=1,
解之得:x=66.7%,
故答案为:66.7%;
Ⅱ、(1)N2 (g)+3H2(g)?2NH3(g),
初始浓度:0.5 0.5 0
变化浓度:0.1 0.3 0.2
平衡浓度:0.4 0.2 0.2
K=$\frac{0.{2}^{2}}{0.4×0.{2}^{3}}$=12.5.故答案为:12.5;
(2)向另一容积为1L的恒容容器B中按物质的量分别为2mol、1mol、1mol充入N2、H2、NH3,此时Qc=$\frac{{1}^{2}}{2×{1}^{3}}$=0.5<K,所以不是平衡状态,会向着正方向进行,
故答案为:否;正.
点评 本题考查学生化学平衡常数的计算以及反应进行的方向知识,注意三行式计算的方法是关键,难度中等.

| A. | 硝酸和氢氧化钠 | B. | 氢氧化铁和盐酸 | C. | 氢氧化钡和硫酸 | D. | 碳酸氢钠和盐酸 |
| A. | 卤素都是活泼的金属元素 | |
| B. | 卤素是常见的成盐元素,都是氧化剂 | |
| C. | 卤素原子最外层都有7个电子 | |
| D. | 卤化氢、卤化银的性质都有相似之处 |
| A. | 8mL | B. | 10mL | C. | 15mL | D. | 23.75mL |
| A. | 沙土 | B. | 水 | C. | 泡沫灭火器 | D. | 煤油 |
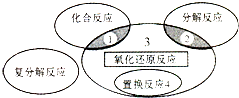
| A. | 4Fe(0H)2+O2+2H2O═4Fe(OH)3 | B. | 2H2O2$\frac{\underline{\;催化剂\;}}{\;}$2H2O+O2↑ | ||
| C. | 3CO+Fe2O3$\frac{\underline{\;高温\;}}{\;}$3CO2+2Fe | D. | Zn+H2SO4═ZnSO4+H2↑ |
| A. | 在常温、常压下,11.2L N2含有的分子数为0.5NA | |
| B. | 标准状况下,18g H2O的体积是22.4L | |
| C. | NA个SO2的体积是22.4L | |
| D. | 标准状况下,22.4L H2 与O2的混合气体所含原子数为2NA |

 已知H2C2O4为二元中强酸.某化学兴趣小组为测定含Na2SO4、NaHC2O4和H2C2O4•2H2O的试样中各物质的质量分数,进行了如下实验:
已知H2C2O4为二元中强酸.某化学兴趣小组为测定含Na2SO4、NaHC2O4和H2C2O4•2H2O的试样中各物质的质量分数,进行了如下实验: