��Ŀ����
���ô�������Ӧ��SO2ת��ΪSO3�ǹ�ҵ����������Ĺؼ����衣��֪�� ��SO2��g����1/2O2��g�� SO3��g��+ 98 kJ
SO3��g��+ 98 kJ
��1��ij�¶��¸÷�Ӧ��ƽ�ⳣ��K��10/3�����ڴ��¶��£���100 L�ĺ����ܱ������У�����3.0 mol SO2(g)��16.0 mol O2(g)��3.0 mol SO3(g)����Ӧ��ʼʱv������
v���棩�����������������������
��2��һ���¶��£���һ�����������Ϊ20 L���ܱ������г���0.4 mol SO2��0.2 mol O2���ﵽƽ��������Ϊ16 L����ƽ���SO2ת���İٷ���Ϊ ��
��3���ڣ�2���еķ�Ӧ�ﵽƽ��ı�������������ʹSO2(g)ƽ��Ũ�ȱ�ԭ����С���� ������ĸ����
| A�������¶Ⱥ�����������䣬����0.2 mol O2 |
| B�������¶Ⱥ�������ѹǿ���䣬����0.4 mol SO3 |
| C�������¶� |
| D���ƶ�����ѹ������ |

������8�֣���1��> ��2�֣���2��60% ��2�֣�
��3��A��C��2�֣���4��16:29 ��2�֣�
����

 ��ĩ1�����ʽ���������ϵ�д�
��ĩ1�����ʽ���������ϵ�д���1����֪1.0mol��L��1NaHSO3��Һ��pHΪ3.5�������Һ����Ũ�ȴӴ�С��˳��Ϊ �������ӷ��ű�ʾ����
 ��2����֤��Na2SO3��Һ�д���ˮ��ƽ��SO32��+H2O
��2����֤��Na2SO3��Һ�д���ˮ��ƽ��SO32��+H2O![]() HSO3��+OH������ʵ�� ������ţ���
HSO3��+OH������ʵ�� ������ţ���
A�������̪��Һ��죬�ټ���H2SO4��Һ��ɫ��ȥ
B�������̪��Һ��죬�ټ�����ˮ���ɫ��ȥ
C�������̪��Һ��죬�ڼ���BaCl2��Һ����������Һ�ɫ��ȥ
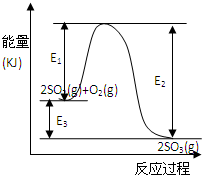
��3����ҵ�����ô�������Ӧ��SO2ת��ΪSO3��2SO2+ O2 ![]() 2SO3����ij�¶��£��˷�Ӧ����ʼŨ��c��SO2��=1.0mol��L��1��c��O2��=1.5mol��L��1���ﵽƽ���SO2��ת����Ϊ50%������¶��¸÷�Ӧ��ƽ�ⳣ��K�� ��
2SO3����ij�¶��£��˷�Ӧ����ʼŨ��c��SO2��=1.0mol��L��1��c��O2��=1.5mol��L��1���ﵽƽ���SO2��ת����Ϊ50%������¶��¸÷�Ӧ��ƽ�ⳣ��K�� ��
��4����������Һ�У������(KIO3)���������ƿɷ������·�Ӧ��
2IO3����5SO32����2H��===I2��5SO42����H2O
���ɵĵ�����õ�����Һ���飬���ݷ�Ӧ��Һ������ɫ�����ʱ���������÷�Ӧ�����ʡ�ijͬѧ���ʵ�����±���ʾ��
| 0.01mol��L��1 KIO3 ������Һ(������)�����/mL | 0.01mol��L��1 Na2SO3 ��Һ�����/mL | H2O����� /mL | ʵ�� �¶� /�� | ��Һ������ɫʱ����ʱ��/s | |
| ʵ��1 | 5 | V1 | 35 | 25 | |
| ʵ��2 | 5 | 5 | 40 | 25 | |
| ʵ��3 | 5 | 5 | V2 | 0 |
����V2=___________mL����ʵ���Ŀ����______________ ______��
 ���ô�������Ӧ��SO2ת��ΪSO3�ǹ�ҵ����������Ĺؼ����裮T��ʱ��Ӧ2SO2��g��+O2��g��?2SO3��g�������е������仯��ͼ��ʾ���ش��������⣮
���ô�������Ӧ��SO2ת��ΪSO3�ǹ�ҵ����������Ĺؼ����裮T��ʱ��Ӧ2SO2��g��+O2��g��?2SO3��g�������е������仯��ͼ��ʾ���ش��������⣮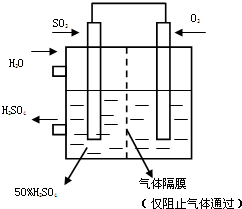

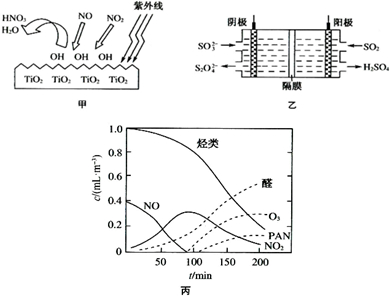
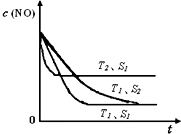 ���������Ǵ�����Ⱦ��֮һ��������������ķ����ж��֣�
���������Ǵ�����Ⱦ��֮һ��������������ķ����ж��֣�