题目内容
用惰性电极电解水时,可加入少量电解质以增强导电性.若要保持产物不变,可加入的物质( )
| A、H2SO4或NaOH |
| B、H2SO4或HCl |
| C、Na2SO4或NaCl |
| D、KOH或CuSO4 |
考点:电解原理
专题:电化学专题
分析:电解水制取H2和O2时,阳极OH-放电,阴极H+放电,为了增强导电性,加入的电解质电离产生的离子不能放电,以此来解答.
解答:
解:A.加入H2SO4或NaOH时,仍然为阳极OH-放电,阴极H+放电,故A选;
B.加入H2SO4时,仍然为阳极OH-放电,阴极H+放电,但加入HCl时,阳极氯离子放电生成氯气,故B不选;
C.加入Na2SO4时,仍然为阳极OH-放电,阴极H+放电,但加入NaCl时,阳极氯离子放电生成氯气,故C不选;
D.加入KOH时,仍然为阳极OH-放电,阴极H+放电,但加入CuSO4时,阴极铜离子放电生成Cu,故D不选;
故选A.
B.加入H2SO4时,仍然为阳极OH-放电,阴极H+放电,但加入HCl时,阳极氯离子放电生成氯气,故B不选;
C.加入Na2SO4时,仍然为阳极OH-放电,阴极H+放电,但加入NaCl时,阳极氯离子放电生成氯气,故C不选;
D.加入KOH时,仍然为阳极OH-放电,阴极H+放电,但加入CuSO4时,阴极铜离子放电生成Cu,故D不选;
故选A.
点评:本题考查电解原理,明确离子的放电顺序是解答本题的关键,熟悉电解原理即可解答,题目难度不大.

练习册系列答案
 中考解读考点精练系列答案
中考解读考点精练系列答案
相关题目
下列说法中错误的是( )
| A、同一元素的各种同位素的化学性质相似 |
| B、元素周期表中从ⅢB族到ⅡB族10个纵行的元素都是金属元素 |
| C、除氦外的稀有气体原子的最外层电子数都是8 |
| D、原子及其离子的核外电子层数等于该元素所在的周期数 |
下列叙述中正确的是( )
| A、VSEPR模型就是分子的空间构型 |
| B、在共价化合物分子中一定存在σ键 |
| C、全由非金属元素组成的化合物一定是共价化合物 |
| D、共价键键长越短,键能一定越大 |
某化学反应2X(g)?Y(g)+Z(g)在4种不同条件下进行,Y、Z起始浓度为0,反应物X的浓度(mol?L-1)随反应时间(min)的变化情况如下表:
下列说法不正确的是( )
| 实验 序号 | 时间 浓度 温度 | 0 | 10 | 20 | 30 | 40 | 50 | 60 |
| 1 | 800℃ | 1.0 | 0.80 | 0.67 | 0.57 | 0.50 | 0.50 | 0.50 |
| 2 | 800℃ | 1.0 | 0.60 | 0.50 | 0.50 | 0.50 | 0.50 | 0.50 |
| 3 | 800℃ | C | 0.92 | 0.75 | 0.63 | 0.60 | 0.60 | 0.60 |
| 4 | 820℃ | 1.0 | 0.40 | 0.25 | 0.20 | 0.20 | 0.20 | 0.20 |
| A、C>1.0 |
| B、实验2可能使用了催化剂 |
| C、实验3比实验2先达到化学平衡状态 |
| D、前10分钟,实验4的平均化学反应速率比实验1的大 |
化学与科学、技术、社会、环境密切相关,下列有关说法不正确的是( )
| A、PM2.5是指大气中直径小于或等于2.5微米的颗粒物,对人体健康或环境有很大影响 |
| B、福岛核电站泄漏的放射性物质131I和127I互为同位素,化学性质几乎相同 |
| C、在黑夜中,我们能看到一束汽车的灯光,是因为我们生活中的大气是胶体体系 |
| D、铝制品在空气中不易被腐蚀是因为铝的性质不活泼 |
高温下,超氧化钾晶体呈立方体结构,晶体中氧的化合价部分为0价,部分为-2价.如图为超氧化钾晶体的一个晶胞(晶体中最小的重复单元),则下列说法中正确的是( )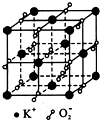

| A、超氧化钾的化学式为KO2,每个晶胞含有4个K+和4个O2- |
| B、晶体中每个K+周围有8个O2-,每个O2-周围有8个K+ |
| C、晶体中与每个K+距离最近的K+有8个 |
| D、晶体中,0价氧原子与-2价氧原子的数目比为1:1 |
 I2在KI溶液中存在下列平衡:I2(aq)+I- (aq)?I3- (aq).某I2、KI混合溶液中,I3-的物质的量浓度c(I3-)与温度T的关系如图所示(曲线上任何一点都表示平衡状态).下列说法正确的是( )
I2在KI溶液中存在下列平衡:I2(aq)+I- (aq)?I3- (aq).某I2、KI混合溶液中,I3-的物质的量浓度c(I3-)与温度T的关系如图所示(曲线上任何一点都表示平衡状态).下列说法正确的是( )| A、反应 I2(aq)+I- (aq)?I3- (aq)的△H>0 |
| B、若温度为T1、T2,反应的平衡常数分别为K1、K2则K1>K2 |
| C、若反应进行到状态D时,一定有υ正<υ逆 |
| D、状态A与状态B相比,状态A的c(I2)大 |
 电渗析法是一种利用离子交换膜进行海水淡化的方法,其原理如图所示.已知海水中含Na+、Cl-、Ca2+、Mg2+、SO42-等离子,电极为惰性电极.下列叙述中正确的是
电渗析法是一种利用离子交换膜进行海水淡化的方法,其原理如图所示.已知海水中含Na+、Cl-、Ca2+、Mg2+、SO42-等离子,电极为惰性电极.下列叙述中正确的是