题目内容
3.常温pH=12的强碱溶液与pH=1的强酸溶液混合,所得混合液的pH=7,则强碱与强酸的体积比是( )| A. | 11:1 | B. | 10:1 | C. | 9:1 | D. | 1:1 |
分析 pH=12的强碱溶液中c(OH-)=0.01mol/L,pH=1的强酸溶液中c(H+)=0.1mol/L,混合液的pH=7,两溶液恰好反应,则n(H+)=n(OH-),设出强碱溶液与强酸溶液的体积,然后根据n=cV计算出二者体积之比即可.
解答 解:设强碱溶液的体积为x,强酸溶液的体积为y,
pH=12的强碱溶液中c(OH-)=0.01mol/L,pH=1的强酸溶液中c(H+)=0.1mol/L,
所得混合液的pH=7,则强碱与强酸溶液中氢离子、氢氧根离子的物质的量相等,
则:n(H+)=n(OH-),
即:0.01x=0.1y,
解得:x:y=10:1,
故选B.
点评 本题考查了溶液酸碱性与溶液pH的简单计算,题目难度不大,试题侧重基础知识的考查,明确溶液酸碱性与溶液pH的关系为解答关键,注意掌握溶液pH的计算方法.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
17.分类是化学学习和研究的常用手段,下列分类依据和结论都正确的是( )
| A. | H2O、HCOOH、Cu2(OH)2CO3均含有氧元素,都是氧化物 | |
| B. | HClO、H2SO4(浓)、HNO3均具有氧化性,都是氧化性酸 | |
| C. | HF、HClO、NH3都易溶于水,都是电解质 | |
| D. | C2H2、H2CO3、H2SO4分子中均含有两个氢原子,都是二元酸 |
18.环境保护是当今社会的热门话题,地球上的能源主要源于太阳,绿色植物的光合作用可以大量吸收CO2以减缓温室效应,主要过程可以用下列三步来描述:
①H2O(l)═2H+(aq)+$\frac{1}{2}$O2(g)+2e-△H=+284kJ•mol-1
②CO2(g)+C5(s)+2H+(aq)═2C3+(s)+H2O(l)+$\frac{1}{2}$O2(g)△H=+396kJ•mol-1
③12C3+(s)+12e-+6H2O(l)═C6H12O6(葡萄糖,s)+6C5(s)△H=-1200kJ•mol-1
下面关于绿色植物利用水和二氧化碳合成葡萄糖并放出氧气的热化学方程式正确的是( )
①H2O(l)═2H+(aq)+$\frac{1}{2}$O2(g)+2e-△H=+284kJ•mol-1
②CO2(g)+C5(s)+2H+(aq)═2C3+(s)+H2O(l)+$\frac{1}{2}$O2(g)△H=+396kJ•mol-1
③12C3+(s)+12e-+6H2O(l)═C6H12O6(葡萄糖,s)+6C5(s)△H=-1200kJ•mol-1
下面关于绿色植物利用水和二氧化碳合成葡萄糖并放出氧气的热化学方程式正确的是( )
| A. | 6CO2(g)+6H2O(l)═C6H12O6(葡萄糖,s)+6O2(g)△H=-1880 kJ•mol-1 | |
| B. | 6CO2(g)+6H2O(l)═C6H12O6(葡萄糖,s)+6O2(g)△H=+2880 kJ•mol-1 | |
| C. | 6CO2(g)+6H2O(l)═C6H12O6(葡萄糖,s)+6O2(g)△H=+2560 kJ•mol-1 | |
| D. | 6CO2(g)+6H2O(l)═C6H12O6(葡萄糖,s)+6O2(g)△H=-1720 kJ•mol-1 |
15.水制取H2的常见原料,下列有关水的说法正确的是( )
| A. | 水分子是一种极性分子,水分子空间结构呈直线型 | |
| B. | H2O分子中有2个由s轨道与sp3杂化轨道形成的σ键 | |
| C. | 水分子间通过H-O键形成冰晶体 | |
| D. | 冰晶胞中水分子的空间排列方式与干冰胞类似 |
2.下列实验装置或实验方案能达到目的是( )
| A. | 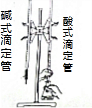 用HF标准溶液测定未知浓度的NaOH溶液 用HF标准溶液测定未知浓度的NaOH溶液 | |
| B. | 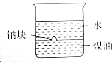 验证密度:ρ(水)<ρ(钠)<ρ(煤油) 验证密度:ρ(水)<ρ(钠)<ρ(煤油) | |
| C. | 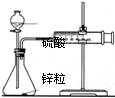 测定锌与硫酸反应的速率 测定锌与硫酸反应的速率 | |
| D. | 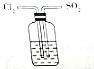 验证SO2和Cl2等物质的量混合增强漂白效果 验证SO2和Cl2等物质的量混合增强漂白效果 |
8.下列物质间的转化不可能通过一步反应实现的是( )
| A. | 铜→氧化铜 | B. | 氢氧化钙→氢氧化钠 | ||
| C. | 铜→碳酸铜 | D. | 碳酸钙→氯化钙 |
15.下列说法中,正确的是( )
| A. | 有机物和无机物都只能从有机体内提取 | |
| B. | 有机物都难溶于水,无机物都易溶于水 | |
| C. | 用化学方法能合成自然界已存在或不存在的有机物 | |
| D. | 有机物参与的反应速率一定比无机物参与的反应慢,且常伴有副反应 |
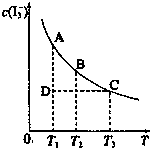 I2在KI溶液中存在下列平衡:I2(aq)+I-(aq)?I-3(aq).I2、KI混合溶液中,I-3的物质的量浓度c(I-3)与温度T的关系如图所示(曲线上任何一点都表示平衡状态).下到说法正确的组合是( )
I2在KI溶液中存在下列平衡:I2(aq)+I-(aq)?I-3(aq).I2、KI混合溶液中,I-3的物质的量浓度c(I-3)与温度T的关系如图所示(曲线上任何一点都表示平衡状态).下到说法正确的组合是( )