题目内容
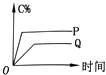
【题目】在t℃时,Ag2CrO4(橘红色)在水中的沉淀溶解平衡平衡曲线如图所示。又知t℃时AgCl的Ksp=4×10-10,下列说法不正确的是( )

A. 在t℃时,Ag2CrO4的Ksp为1×10-8
B. 在饱和溶液中加入K2CrO4可使溶液由Y点到Z点
C. 在t℃时,Ag2CrO4(s)+2Cl-(aq)![]() 2AgCl(s)+CrO42-(aq)平衡常数K=6.25×107
2AgCl(s)+CrO42-(aq)平衡常数K=6.25×107
D. 在t℃时,以0.001mol/L AgNO3溶液滴定20mL 0.001mol/L KCl和0.001mol/L的K2CrO4的混合溶液,Cl-先沉淀
【答案】A
【解析】A、根据溶度积的公式,Ksp=c2(Ag+)×c(CrO42-)=10-6×10-5=10-11,故A说法错误;B、饱和溶液中,加入K2CrO4,c(CrO42-)增大,溶度积因为只受温度的影响,因此溶度积不变,c(Ag+)减小,因此从Y点到Z点,故B说法正确;C、K的表达式为K=c(CrO42-)/c2(Cl-)=c2(Ag+)×c(CrO42-)/[c2(Ag+)×c2(Cl-)]=Ksp(Ag2CrO4)/Ksp2(AgCl)=10-11/(4×10-10)2=6.25×107,故C正确;D、AgCl沉淀时,需要c(Ag+)=Ksp/c(Cl-)=4×10-10/0.001mol/l=4×10-7mol·L-1,Ag2CrO4沉淀时,c2(Ag+)=Ksp/c(CrO42-)=10-11/0.001mol·L-1=10-8mol·L-1,即c(Ag+)=10-4mol·L-1,因此AgCl先沉淀,故D正确。

【题目】表是元素周期表的一部分,其中每个数字序号代表一种短周期元素.
① | ||||||||
② | ③ | |||||||
④ | ⑤ | ⑥ | ||||||
请按要求回答下列问题:
(1)元素②在周期表中的位置为
(2)④、⑤两种元素相比较,金属性强的是(填元素符号);
(3)这些元素的最高价氧化物对应水化物中酸性最强的是(填化学式,下同),具有两性的是 .
(4)元素④和元素⑥形成的化合物的电子式为 .
(5)元素③和元素⑥的氢化物均极易溶于水,用两根玻璃棒分别蘸取它们的浓溶液,相互接近时,可看到大量的白烟,写出产生该现象的化学方程式 .