题目内容
将2molX和2molY充入2L密闭容器中发生如下反应:X(g)+3Y(g)?2Z(g)+aQ(g),达到平衡时生成0.8molZ,测得Q的浓度为0.4mol/L,下列叙述错误的是( )
分析:A.根据n=cV计算生成的Q的物质的量,再根据物质的量之比等于化学计量数之比计算a的值;
B.根据生成的n(Z),利用物质的量之比等于化学计量数之比计算参加反应的X的物质的量,进而计算平衡时X的物质的量,再根据c=
计算;
C.根据生成的n(Z),利用物质的量之比等于化学计量数之比计算参加反应的Y的物质的量,再根据转化率定义计算;
D.计算平衡时混合气体总的物质的量,Z的体积分数=
×100%.
B.根据生成的n(Z),利用物质的量之比等于化学计量数之比计算参加反应的X的物质的量,进而计算平衡时X的物质的量,再根据c=
| n |
| V |
C.根据生成的n(Z),利用物质的量之比等于化学计量数之比计算参加反应的Y的物质的量,再根据转化率定义计算;
D.计算平衡时混合气体总的物质的量,Z的体积分数=
| 平衡时Z的物质的量 |
| 平衡时总的物质的量 |
解答:解:A.平衡时生成0.8mol Z,测得Q的浓度为0.4mol?L-1,则生成的n(Q)=0.4mol?L-1×2L=0.8mol,所以2:a=0.8mol:0.8mol,解得a=2,故A正确;
B.平衡时生成0.8molZ,则参加反应的X的物质的量为0.8mol×
=0.4mol,故平衡时X的物质的量为2mol-0.4mol=1.6mol,平衡时X的浓度为
=0.8mol/L,故B错误;
C.平衡时生成0.8molZ,则参加反应的Y的物质的量为0.8mol×
=1.2mol,故Y的转化率为
×100%=60%,故C正确;
D.由于a=2,反应前后混合气体总的物质的量不变,故平衡时Z的体积分数=
×100%=20%,故D正确,
故选:B.
B.平衡时生成0.8molZ,则参加反应的X的物质的量为0.8mol×
| 1 |
| 2 |
| 1.6mol |
| 2L |
C.平衡时生成0.8molZ,则参加反应的Y的物质的量为0.8mol×
| 3 |
| 2 |
| 1.2mol |
| 2mol |
D.由于a=2,反应前后混合气体总的物质的量不变,故平衡时Z的体积分数=
| 0.8mol |
| 2mol+2mol |
故选:B.
点评:本题考查化学平衡的有关计算,难度中等,注意对基础知识的理解掌握.

练习册系列答案
 同步练习强化拓展系列答案
同步练习强化拓展系列答案
相关题目
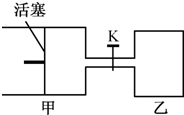 (2011?南京一模)如图所示,向甲和乙两容器中都充入2molX和2molY(K关闭) 起始V甲=0.8aL,V乙=aL,在相同恒定温度下,两容器中各自发生下列反应:X(g)+Y(g)═2Z(g)+W(g),达到平衡时,V甲=0.9aL,则下列说法错误的是( )
(2011?南京一模)如图所示,向甲和乙两容器中都充入2molX和2molY(K关闭) 起始V甲=0.8aL,V乙=aL,在相同恒定温度下,两容器中各自发生下列反应:X(g)+Y(g)═2Z(g)+W(g),达到平衡时,V甲=0.9aL,则下列说法错误的是( )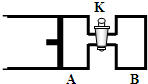 如图所示,向A中充入1molX和1molY,向B中充入2molX和2molY,起始VA=VB=aL,在相同的温度和有催化剂的条件下,两容器中各自发生下列反应:X(g)+Y(g)?2Z(g)+W(g);△H>0 达到平衡时,VA=1.2aL.则下列说法错误的是( )
如图所示,向A中充入1molX和1molY,向B中充入2molX和2molY,起始VA=VB=aL,在相同的温度和有催化剂的条件下,两容器中各自发生下列反应:X(g)+Y(g)?2Z(g)+W(g);△H>0 达到平衡时,VA=1.2aL.则下列说法错误的是( )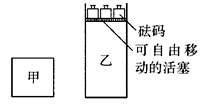 A.向甲容器中再充入2molX和2molY,平衡后甲中物质Z的浓度不变
A.向甲容器中再充入2molX和2molY,平衡后甲中物质Z的浓度不变