题目内容
【题目】臭氧(O3)主要分布在大气层的平流层中,能够吸收紫外线,被称为地球的保护伞。回答下列问题:
(1)NOx对臭氧层的破坏作用极大,已知:①NO+O3=NO2+O2 K1;NO2+O2=NO+O3; K2;③O2+O=O3 K3,反应2O3=3O2的平衡常数K=_______ (用K1、K2、K3表示),写出一种保护臭氧层的措施:__________。
(2)用臭氧氧化烟气中的SO2的主要反应为SO2(g)+O3(g)=SO3(g)+O2(g) △H,已知①2SO2(g)+O2(g)=2SO3(g) △H1=-198kJ/mol,②2O3(g)=3O2(g) △H2=+284.2kJ/mol
①上述反应中△H= ____kJmol-1。
②一定温度下,向2L固定容积的密闭容器中加入2molO3和2molSO2发生上述反应,5min后达到平衡,测得容器中含有0.4molL-1SO3,此时SO2的转化率为_______,欲提高O3的利用率可采取的措施有_______(填字母)。
a.适当增大压强 b.升高温度 c.使用优质催化剂 d.及时分离出SO3
(3)工业上用CaSO3悬浊液吸收上述转化生成的SO3可制备石膏。已知:298K时Ksp(CaSO4)=9.0×10-6,Ksp(CaSO3)=1.5×10-7,向1LCaSO3悬浊液中加入Na2SO4,若有0.1molCaSO3参与反应,则需加入_______molNa2SO4。
 ,
,
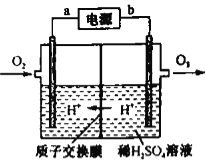
(4)工业上可采用惰性电极电极电解稀硫酸的方法制备O3,反应装置如上图所示,电源的a极为_____极,通入O2的电极反应式为_______。
【答案】![]() 减少氮氧化物的排放或减少氟氯烃的使用等 -241.1 40% d 6.1 负极 O2+4e-+4H+=2H2O
减少氮氧化物的排放或减少氟氯烃的使用等 -241.1 40% d 6.1 负极 O2+4e-+4H+=2H2O
【解析】
(1)根据盖斯定律,可知反应①+②-③可得目标反应2O3=3O2,则化学方程式相加减,化学平衡向乘数,2O3=3O2的平衡常数![]() ;O3在NOx的作用下会发生分解生成氧气,保护臭氧层,可以减少NOx的排放,或者减少氟氯烃的使用等;
;O3在NOx的作用下会发生分解生成氧气,保护臭氧层,可以减少NOx的排放,或者减少氟氯烃的使用等;
(1)①根据盖斯定律,![]() (反应①-反应②)可得目标反应SO2(g)+O3(g)=SO3(g)+O2(g),则△H=
(反应①-反应②)可得目标反应SO2(g)+O3(g)=SO3(g)+O2(g),则△H=![]() (-198-284.2)kJ·mol-1=-241.1kJ·mol-1;
(-198-284.2)kJ·mol-1=-241.1kJ·mol-1;
②达到平衡后,容器中SO3的浓度为0.4mol·L-1,则生成SO3的物质的量n=0.4mol·L-1×2L=0.8mol,根据化学方程式,生成0.8molSO3需要消耗0.8molSO2,则SO2的转化率![]() ;
;
欲提高O3的利用率,a.适当增大压强,该反应是反应前后气体体积不变的反应,增大压强平衡不移动,O3的利用率不变,a不符合题意;b.升高温度,该反应为放热反应,升高温度,平衡逆向移动,O3的转化率降低,b不符合题意;c.使用优质催化剂,催化剂可以加快化学反应速率,但是不影响平衡移动,O3的利用率不变,c不符合题意;d.及时分离SO3,促进平衡正向移动,O3的利用率增大,d符合题意;答案选d;
(3)根据题意,CaSO3悬浊液中加入Na2SO4,发生反应,CaSO3(s)+SO42-(aq)![]() =CaSO4(s)+SO32-(aq),该反应的平衡常数
=CaSO4(s)+SO32-(aq),该反应的平衡常数![]() ,0.1molCaSO3参与反应,生成CaSO4的物质的量为0.1mol,则沉淀消耗Na2SO4的物质的量为0.1mol;溶液中含有的SO32-的物质的量为0.1mol,其物质的量浓度
,0.1molCaSO3参与反应,生成CaSO4的物质的量为0.1mol,则沉淀消耗Na2SO4的物质的量为0.1mol;溶液中含有的SO32-的物质的量为0.1mol,其物质的量浓度![]() ,根据平衡常数可知,
,根据平衡常数可知,![]() ,则溶液中的c(SO42-)=6mol·L-1。为了维持溶液中的c(SO42-)=6mol·L-1,需要消耗Na2SO4的物质的量n=6mol·L-1×1L=6mol,则总共消耗Na2SO4的物质的量为0.1mol+6mol=6.1mol;
,则溶液中的c(SO42-)=6mol·L-1。为了维持溶液中的c(SO42-)=6mol·L-1,需要消耗Na2SO4的物质的量n=6mol·L-1×1L=6mol,则总共消耗Na2SO4的物质的量为0.1mol+6mol=6.1mol;
(4)根据图示,利用电解法制取O3,H+由右侧经质子交换膜向左侧移动;在电解池中,阳离子向阴极移动,则左侧为阴极区,a为电源的负极。在酸性电解质溶液中,O2得到电子生成H2O,则电解方程式为O2+4e-+4H+=2H2O。