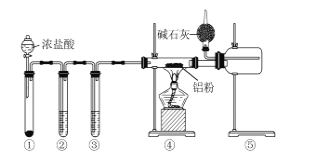
题目内容
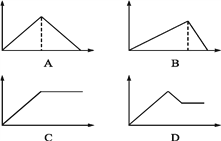
【题目】下列实验过程中产生沉淀的物质的量(Y)与加入试剂的物质的量(X)之间的关系正确的是( )
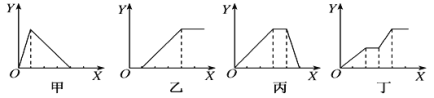
A.丙向NH4Al(SO4)2溶液中逐滴加入NaOH溶液直至过量
B.丁向NaOH、Ba(OH)2、NaAlO2的混合溶液中逐渐通入CO2至过量
C.乙向NaAlO2溶液中滴加稀盐酸至过量且边滴边振荡
D.甲向AlCl3溶液中逐滴加入NaOH溶液至过量且边滴边振荡
【答案】A
【解析】
A.向NH4Al(SO4)2溶液中逐滴加入氢氧化钠溶液,开始滴加NaOH发生反应为Al3++3OH-=Al(OH)3↓,先产生氢氧化铝沉淀,当Al3+沉淀完全后,然后发生反应NH4++OH-=NH3H2O,此时沉淀氢氧化铝的量不变,最后继续滴加NaOH,发生反应Al(OH)3+OH-=AlO2-+2H2O,氢氧化铝沉淀溶解,沉淀量达到最大消耗NaOH、沉淀量不变和沉淀溶解消耗NaOH的比为3:1:1;故A正确;
B.向NaOH、Ba(OH)2、NaA1O2的混合溶液中逐渐通入二氧化碳至过量,先发生反应:Ba(OH)2+CO2=BaCO3↓+H2O,产生沉淀,然后发生反应:CO2+2NaOH=Na2CO3+H2O,此时沉淀的量不变,再发生反应2NaAlO2+CO2+3H2O=2Al(OH)3↓+Na2CO3,产生沉淀,又发生反应: Na2CO3+H2O+CO2=2NaHCO3沉淀量不变,最后发生反应:BaCO3+2H2O+2CO2=Ba(HCO3)2,沉淀部分溶解,故B错误;
C.向NaAlO2溶液中滴加稀盐酸,开始阶段先产生氢氧化铝沉淀,发生反应:AlO2-+H++H2O=Al(OH)3↓,随着盐酸的逐滴加入,则沉淀开始溶解,发生反应:Al(OH)3+3H+=Al3++3H2O,所以沉淀量达到最大消耗的盐酸和沉淀完全溶解消耗的盐酸的物质的量之比是1:3.故C错误;
D.向AlCl3溶液中逐滴加入NaOH溶液至过量且边滴边振荡,先产生氢氧化铝沉淀:AlCl3+3NaOH=Al(OH)3↓+3NaCl,继续滴加NaOH溶液,Al(OH)3和NaOH溶液反应,生成偏铝酸钠,沉淀溶解:NaOH+Al(OH)3=NaAlO2+2H2O,所以沉淀量达到最大消耗NaOH和沉淀溶解消耗NaOH的比为3:1;故D错误;
故答案为A。

【题目】[化学一选修3:物质结构与性质
(1)Ti(BH4)3是一种储氢材料,可由TiCl4和LiBH4反应制得。
①基态Ti3+的未成对电子数有__________个。
②LiBH4由Li+和BH4-构成,BH4-的空间构型是__________,B原子的杂化轨道类型是_____。
③某储氢材料是第三周期金属元素M的氢化物,M的部分电离能如下表所示:
I1/kJ·mol-1 | I2/kJ·mol-1 | I3/kJ·mol-1 | I4/kJ·mol-1 | I5/kJ·mol-1 |
738 | 1451 | 7733 | 10540 | 13630 |
M是_______(填元素符号),判断理由为_______________。
(2)铜晶体中铜原子的堆积方式如图所示,铜晶体中原子的堆积模型属于____________。

(3)A原子的价电子排布式为3s23p5,铜与A 形成化合物的晶胞如图所示(黑点代表铜原子)。
①该晶体的化学式为______________。
②该化合物难溶于水但易溶于氨水,其原因是_____________ ,此化合物的氨水溶液遇到空气则被氧化为深蓝色,深蓝色溶液中阳离子的化学式为____________。
③己知该晶体的密度为ρg·cm-3,阿伏伽德罗常数为NA,己知该晶体中Cu原子和A原子之间的最短距离为体对角线的1/4,则该晶体中Cu原子和A原子之间的最短距离为________pm。