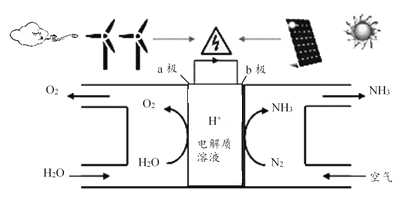
题目内容
【题目】下列指定反应的离子方程式正确的是
A. 用高锰酸钾标准溶液滴定草酸:2MnO4-+16H++5C2O42-===2Mn2++10CO2↑+8H2O
B. Cl2与FeBr2溶液反应,当n(Cl2):n(FeBr2)=1:1时,2Fe2++2Br-+2Cl2=2Fe3++Br2+4Cl-
C. 惰性电极电解MgCl2溶液:2Cl+2H2O![]() Cl2↑+2OH-+ H2↑
Cl2↑+2OH-+ H2↑
D. 向NaHSO4溶液中滴入Ba(OH)2溶液至中性:H++SO42-+Ba2++OH- ===BaSO4↓+H2O
【答案】B
【解析】
A、草酸属于弱酸,书写离子方程式时不能拆写,正确的是2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O,故A错误;B、Fe2+还原性比Br-强,先与Cl2发生反应,根据得失电子数目守恒,1×1+n(Br-)×1=1×2×1,解得n(Br-)=1mol,因此反应的离子方程式为2Fe2++2Br-+2Cl2=2Fe3++Br2+4Cl-,故B正确;C、缺少Mg2+与OH-反应生成Mg(OH)2,故C错误;D、反应后溶液为中性,则离子方程式为2H++SO42-+Ba2++2OH-=BaSO4↓+2H2O,故D错误。

 阅读快车系列答案
阅读快车系列答案【题目】如图利用培养皿探究氨气的性质。实验时向NaOH固体上滴几滴浓氨水,立即用另一表面皿扣在上面。下表中对实验现象所做的解释正确的是

选项 | 实验现象 | 解释 |
A | 浓盐酸附近产生白烟 | NH3与浓盐酸反应生成了NH4Cl固体 |
B | 浓硫酸附近无明显现象 | NH3与浓硫酸不发生反应 |
C | 氯化物溶液变浑浊 | 该溶液一定是AlCl3溶液 |
D | 干燥的红色石蕊试纸不变色,湿润的红色石蕊试纸变蓝 | NH3是一种可溶性碱 |
A. AB. BC. CD. D
【题目】氯化铁可用作金属蚀刻、有机合成的催化剂,研究其制备及性质是一个重要的课题。
(1)氯化铁晶体的制备(夹持及加热装置省略):

①实验过程中装置丙中可能发生反应的离子方程式有____________。
②该装置气密性检查方法及操作:_________________________。
(2)氯化铁的性质探究:
为探究氯化铁的性质设计了如下实验。(查阅文献知:①氯化铁的熔点为306℃、沸点为315℃,易升华,气态FeCl3会分解成FeCl2和Cl2 ②FeCl2熔点670℃)
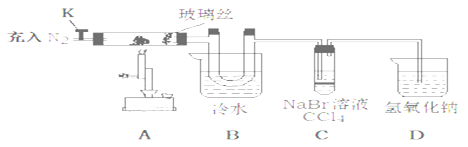
操作步骤 | 实验现象 | 解释原因 |
打开K,充入氮气 | D中有气泡产生 | ①充入N2的原因___________。 |
关闭K,加热至600℃,充分灼烧固体 | B中出现棕黄色固体 | ②产生现象的原因__________________________。 |
实验结束,振荡C静置 | ③_____________ | ④________________________。(用方程式解释) |