题目内容
甲、乙、丙、丁、戊均为中学化学常见的单质或化合物,且均含有同一种非金属元素R,在一定条件下其转化关系如图1所示.
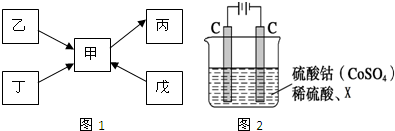
Ⅰ.若甲、乙、丙、丁均为气体,甲、丙为常见大气污染物,且甲与丙的相对分子质量相差16,乙分子是一种10e-微粒,丁为空气的主要成分之一.
(1)乙的空间构型为 ,丁的电子式为 .
(2)戊的稀溶液能跟过量铁粉反应,其离子方程式为 .
Ⅱ.若上述五种物质含有不同的官能团,丁为带水果香味的液体,乙和丁均能在碱性条件下生成甲,戊是一种无色气体,相同条件下相对H2的密度为14.
(1)写出由甲生成戊的化学方程式 ,
(2)甲的一种同系物X(相对分子质量比甲小),对水质会造成一定的污染,可用电化学法消除这种污染,其原理是通电后,将Co2+氧化成Co3+,然后以Co3+作氧化剂把水中的X氧化成CO2而净化.实验室用图2装置模拟上述过程:
①完成除去X的离子方程式:6Co3++ +H2O═CO2↑+6Co2++
②若装置中的电源为甲烷-空气-KOH溶液的燃料电池,则净化含1mol X的水,理论上该燃料电池需消耗KOH mol.
③以CH4和H2O为原料,通过下列反应来制备X.
CH4(g)+H2O(g)═CO(g)+3H2(g)△H=+206.0kJ?mol-1
CO(g)+2H2(g)═X(g)△H=-129.0kJ?mol-1
写出CH4(g)与H2O(g)反应生成X(g)和H2(g)的热化学方程式 .

Ⅰ.若甲、乙、丙、丁均为气体,甲、丙为常见大气污染物,且甲与丙的相对分子质量相差16,乙分子是一种10e-微粒,丁为空气的主要成分之一.
(1)乙的空间构型为
(2)戊的稀溶液能跟过量铁粉反应,其离子方程式为
Ⅱ.若上述五种物质含有不同的官能团,丁为带水果香味的液体,乙和丁均能在碱性条件下生成甲,戊是一种无色气体,相同条件下相对H2的密度为14.
(1)写出由甲生成戊的化学方程式
(2)甲的一种同系物X(相对分子质量比甲小),对水质会造成一定的污染,可用电化学法消除这种污染,其原理是通电后,将Co2+氧化成Co3+,然后以Co3+作氧化剂把水中的X氧化成CO2而净化.实验室用图2装置模拟上述过程:
①完成除去X的离子方程式:6Co3++
②若装置中的电源为甲烷-空气-KOH溶液的燃料电池,则净化含1mol X的水,理论上该燃料电池需消耗KOH
③以CH4和H2O为原料,通过下列反应来制备X.
CH4(g)+H2O(g)═CO(g)+3H2(g)△H=+206.0kJ?mol-1
CO(g)+2H2(g)═X(g)△H=-129.0kJ?mol-1
写出CH4(g)与H2O(g)反应生成X(g)和H2(g)的热化学方程式
考点:无机物的推断,热化学方程式,原电池和电解池的工作原理,有机物的推断
专题:推断题,化学反应中的能量变化,电化学专题
分析:Ⅰ.甲与丙为常见大气污染物,且甲与丙的相对分子质量相差16,则甲应为NO,丙为NO2,丁为空气的主要成分之一,应为N2,则乙为NH3,戊的稀溶液能跟过量铁粉反应,且能生成NO,应为HNO3;
Ⅱ.丁为带水果香味的液体,应为酯类物质,乙和丁均能在碱性条件下生成甲,戊是一种无色气体,相同条件下相对H2的密度为14,应为CH2=CH2,则甲为CH3CH2OH,乙应为氯代烃,结合对应物质的性质以及题目要求解答该题.
Ⅱ.丁为带水果香味的液体,应为酯类物质,乙和丁均能在碱性条件下生成甲,戊是一种无色气体,相同条件下相对H2的密度为14,应为CH2=CH2,则甲为CH3CH2OH,乙应为氯代烃,结合对应物质的性质以及题目要求解答该题.
解答:
解:Ⅰ.甲与丙为常见大气污染物,且甲与丙的相对分子质量相差16,则甲应为NO,丙为NO2,丁为空气的主要成分之一,应为N2,则乙为NH3,戊的稀溶液能跟过量铁粉反应,且能生成NO,应为HNO3,
(1)丁为N2,电子式为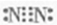 ,乙为NH3,为三角锥形分子,故答案为:三角锥形;
,乙为NH3,为三角锥形分子,故答案为:三角锥形;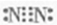 ;
;
(2)稀硝酸与过量铁粉反应生成硝酸亚铁和NO气体,反应的离子方程式为3Fe+8H++2NO3-═3Fe2++2NO↑+4H2O,
故答案为:3Fe+8H++2NO3-═3Fe2++2NO↑+4H2O;
Ⅱ.丁为带水果香味的液体,应为酯类物质,乙和丁均能在碱性条件下生成甲,戊是一种无色气体,相同条件下相对H2的密度为14,应为CH2=CH2,则甲为CH3CH2OH,乙应为氯代烃,
(1)乙醇在浓硫酸作用下加热至170℃可生成乙烯,反应的方程式为CH3CH2OH
CH2=CH2↑+H2O,
故答案为:CH3CH2OH
CH2=CH2↑+H2O;
(2)①甲为CH3CH2OH,对应的最简单的同系物为CH3OH,反应中Co元素化合价由+3价降低到+2价,C元素化合价由-2价升高到+4价,反应的离子方程式为6Co3++CH3OH+H2O═CO2↑+6Co2++6H+,
故答案为:CH3OH;6H+;
②甲醇-空气-KOH溶液的燃料电池的总反应方程式为2CH3OH+3O2+4KOH═2K2CO3+6H2O,CH3OH与KOH的物质的量之比为1:2,1molCH3OH反应,应有2molKOH参与反应.
故答案为:2;
③已知:I:CH4 (g)+H2O (g)=CO (g)+3H2 (g)△H=+206.0kJ?mol-1,
II:CO (g)+2H2 (g)=CH3OH (g)△H=-129.0kJ?mol-1,
依据盖斯定律,Ⅰ+Ⅱ得到:CH4(g)+H2O(g)=CH3OH (g)+H2(g))△H=+77kJ?mol-1,
故答案为:CH4(g)+H2O(g)═CH3OH(g)+H2(g)△H=+77.0 kJ?mol-1.
(1)丁为N2,电子式为
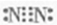 ,乙为NH3,为三角锥形分子,故答案为:三角锥形;
,乙为NH3,为三角锥形分子,故答案为:三角锥形;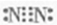 ;
;(2)稀硝酸与过量铁粉反应生成硝酸亚铁和NO气体,反应的离子方程式为3Fe+8H++2NO3-═3Fe2++2NO↑+4H2O,
故答案为:3Fe+8H++2NO3-═3Fe2++2NO↑+4H2O;
Ⅱ.丁为带水果香味的液体,应为酯类物质,乙和丁均能在碱性条件下生成甲,戊是一种无色气体,相同条件下相对H2的密度为14,应为CH2=CH2,则甲为CH3CH2OH,乙应为氯代烃,
(1)乙醇在浓硫酸作用下加热至170℃可生成乙烯,反应的方程式为CH3CH2OH
| 浓硫酸 |
| 170℃ |
故答案为:CH3CH2OH
| 浓硫酸 |
| 170℃ |
(2)①甲为CH3CH2OH,对应的最简单的同系物为CH3OH,反应中Co元素化合价由+3价降低到+2价,C元素化合价由-2价升高到+4价,反应的离子方程式为6Co3++CH3OH+H2O═CO2↑+6Co2++6H+,
故答案为:CH3OH;6H+;
②甲醇-空气-KOH溶液的燃料电池的总反应方程式为2CH3OH+3O2+4KOH═2K2CO3+6H2O,CH3OH与KOH的物质的量之比为1:2,1molCH3OH反应,应有2molKOH参与反应.
故答案为:2;
③已知:I:CH4 (g)+H2O (g)=CO (g)+3H2 (g)△H=+206.0kJ?mol-1,
II:CO (g)+2H2 (g)=CH3OH (g)△H=-129.0kJ?mol-1,
依据盖斯定律,Ⅰ+Ⅱ得到:CH4(g)+H2O(g)=CH3OH (g)+H2(g))△H=+77kJ?mol-1,
故答案为:CH4(g)+H2O(g)═CH3OH(g)+H2(g)△H=+77.0 kJ?mol-1.
点评:本题综合考查无机物的推断和有机物的推断,注意把握物质的特征性质,为解答该题的关键,注意把握相关物质的性质,题目难度中等.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
用NA表示阿伏加德罗常数,下列叙述中正确的是( )
A、在标准状态下,1L庚烷完全燃烧后,所生成的气态产物的分子数为
| ||
| B、1mol碳正离子CH3+所含的电子数为10NA | ||
| C、在人体内,180g葡萄糖完全被生理氧化所消耗的氧气的分子数为6NA | ||
| D、0.5mol苯乙烯分子中含有1.5NA碳碳单键和2NA碳碳双键 |
下列有关说法不正确的是( )
| A、二氧化碳是造成全球变暖的主要的温室气体 |
| B、甲烷、氟代烃、全氟化碳都是有机化合物 |
| C、氟代烃能够破坏臭氧层 |
| D、C3F8有2种结构 |
下列有关说法中不正确的是( )
| A、高纯度的二氧化硅用于制作光导纤维,光导纤维遇强碱会“断路” |
| B、l31I和127I互为同位素,化学性质几乎相同 |
| C、NO和NO2等氮氧化物是形成光化学烟雾和酸雨的一个重要原因 |
| D、煤经过气化和液化两个物理变化,可变为清洁能源 |

 ,分子式:
,分子式: )在催化剂作用下生成聚苯丙烯的反应方程式:
)在催化剂作用下生成聚苯丙烯的反应方程式: 与Br2以物质的量之比为1:1反应,所得产物有
与Br2以物质的量之比为1:1反应,所得产物有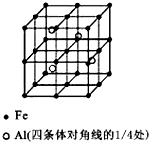 一种Al-Fe合金的立体晶胞如图所示.请据此回答下列问题:
一种Al-Fe合金的立体晶胞如图所示.请据此回答下列问题: 与
与 ④O2和O3 ⑤氯水和氯气
④O2和O3 ⑤氯水和氯气 的一氯取代物有
的一氯取代物有 所含官能团的名称是
所含官能团的名称是 若
若 在上述类似条件下发生反应,请模仿上例写出该反应的方程式:
在上述类似条件下发生反应,请模仿上例写出该反应的方程式: 中的碳原子分别称为伯、仲、叔、季碳原子,数目分别用n1、n2、n3、n4表示.例如:
中的碳原子分别称为伯、仲、叔、季碳原子,数目分别用n1、n2、n3、n4表示.例如: 分子中,n1=6、n2=1、n3=2、n4=1.试根据不同烷烃的组成结构,分析出烷烃(除甲烷外)中各原子数的关系.四种碳原子数之间的关系为n1=
分子中,n1=6、n2=1、n3=2、n4=1.试根据不同烷烃的组成结构,分析出烷烃(除甲烷外)中各原子数的关系.四种碳原子数之间的关系为n1=