题目内容
6.在一定温度下,向恒容密闭容器中加入2mol X和4mol Y,发生如下反应:X(s)+2Y(g)?2Z(g),此反应达到平衡的标志是( )| A. | 容器内压强不随时间变化 | B. | V正(X)=2V逆(Z) | ||
| C. | 容器内X、Y、Z的浓度相等 | D. | 容器内气体密度不变 |
分析 反应到达平衡状态时,正逆反应速率相等,平衡时各物质的浓度、百分含量不变,以及由此衍生的一些量也不发生变化,由此进行判断.
解答 解:A、该反应是反应前后气体体积不发生变化的反应,容器中的压强始终不发生变化,所以不能证明达到了平衡状态,故C错误;
B、V正(X)=2V逆(Z)不能说明正逆反应速率相等,不能说明反应达到平衡状态,故B错误;
C、该反应达到平衡状态时,各种气体的物质的量浓度不变,但是各物质的量浓度相等不能说明该反应达到平衡状态,故C错误;
D、该容器的体积保持不变,根据质量守恒定律知,反应前后混合气体的质量变化,所以容器内气体的密度变,当容器中气体的密度不再发生变化时,能表明达到化学平衡状态,故D正确;
故选D.
点评 本题考查化学平衡状态的判断,难度不大,注意只有反应前后不相同的量才能作为判断化学平衡的依据,反应前后不改变的量不能作为判断化学平衡的依据,如该反应中的密度就不能作为判断化学平衡的依据.

练习册系列答案
 浙大优学小学年级衔接捷径浙江大学出版社系列答案
浙大优学小学年级衔接捷径浙江大学出版社系列答案
相关题目
8.实验室需要配制离子浓度均为1mol•L-1,下列离子的溶液,你认为能配制成功的是( )
| A. | Al3+、NO3-、K+、SO42- | B. | Cu2+、Ba2+、SO42-、CO32- | ||
| C. | OH-、Cl-、NH4-、Na+ | D. | Mg2+、Na+、SO42-、NO3- |
17.元素的性质呈现周期性变化的根本原因是满( )
| A. | 元素的相对原子质量递增,量变引起质变 | |
| B. | 元素原子核外电子排布呈周期性变化 | |
| C. | 元素的原子半径由大到小变化 | |
| D. | 元素的化合价呈周期性变化 |
14.科学家研究表明:聚乙炔经溴或碘掺杂之后导电性会提高到金属水平,如今聚乙炔已用于制备太阳能电池、半导体材料和电活性聚合物等.下列有关聚乙炔的叙述错误的是( )
| A. | 聚乙炔属于混合物 | B. | 聚乙炔的分子中不含有碳碳叁键 | ||
| C. | 聚乙炔的相对分子质量为26 | D. | 聚乙炔中碳的质量分数为92.3% |
1. 某课外兴趣小组以正丁醇为主要原料,利用图示装置制备1-溴丁烷.实验过程如下:
某课外兴趣小组以正丁醇为主要原料,利用图示装置制备1-溴丁烷.实验过程如下:
Ⅰ制备:圆底烧瓶中依次加入5mL水、5mL浓硫酸、3.1mL正丁醇和4.2g NaBr,按如图安装反应装置,用小火加热混合物至沸腾,保持回流30min,在此过程中要不断摇动反应瓶;
Ⅱ分离:移去热源,稍冷后拆去回流装置,把装置改成普通蒸馏装置,接着进行蒸馏操作,得到粗产品;
Ⅲ提纯:粗产品经洗涤、干燥、蒸馏等操作,得到产品.
回答下列问题:
(1)制备装置中冷凝管的作用是冷凝回流、导气,冷凝水的进水口为B(填“A”或“B”).
(2)加热回流后,反应瓶中的物料呈红棕色,其原因是2HBr+H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$Br2↑+SO2↑+2H2O(用化学方程式表示).
(3)在制备1-溴丁烷时不能边反应边蒸出产物,其原因是1-溴丁烷与正丁醇的沸点差较小,若边反应边蒸出产物,会有较多的正丁醇挥发,降低原料的利用率.
(4)要除去1-溴丁烷中含有的少量杂质Br2,下列物质中最适合的是C.
A.NaCl B.NaOH C.NaHSO3 D.KCl.
 某课外兴趣小组以正丁醇为主要原料,利用图示装置制备1-溴丁烷.实验过程如下:
某课外兴趣小组以正丁醇为主要原料,利用图示装置制备1-溴丁烷.实验过程如下:Ⅰ制备:圆底烧瓶中依次加入5mL水、5mL浓硫酸、3.1mL正丁醇和4.2g NaBr,按如图安装反应装置,用小火加热混合物至沸腾,保持回流30min,在此过程中要不断摇动反应瓶;
Ⅱ分离:移去热源,稍冷后拆去回流装置,把装置改成普通蒸馏装置,接着进行蒸馏操作,得到粗产品;
Ⅲ提纯:粗产品经洗涤、干燥、蒸馏等操作,得到产品.
| 物质 | 颜色、状态 | 沸点(℃) | 密度(g•mL-1) | 水溶性 |
| 正丁醇 | 无色液体 | 117.2 | 0.8098 | 易溶 |
| 1-溴丁烷 | 无色液体 | 101.6 | 1.2758 | 难溶 |
(1)制备装置中冷凝管的作用是冷凝回流、导气,冷凝水的进水口为B(填“A”或“B”).
(2)加热回流后,反应瓶中的物料呈红棕色,其原因是2HBr+H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$Br2↑+SO2↑+2H2O(用化学方程式表示).
(3)在制备1-溴丁烷时不能边反应边蒸出产物,其原因是1-溴丁烷与正丁醇的沸点差较小,若边反应边蒸出产物,会有较多的正丁醇挥发,降低原料的利用率.
(4)要除去1-溴丁烷中含有的少量杂质Br2,下列物质中最适合的是C.
A.NaCl B.NaOH C.NaHSO3 D.KCl.
11.下列说法正确的是 ( )
| A. |  的命名为:2-甲基-1-丙醇 的命名为:2-甲基-1-丙醇 | |
| B. | 有机物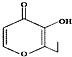 (俗称“一滴香”)的一种含苯环的同分异构体能发生银镜反应 (俗称“一滴香”)的一种含苯环的同分异构体能发生银镜反应 | |
| C. | 布洛芬结构如图所示 该物质可发生氧化、还原、加成、消去、取代反应 该物质可发生氧化、还原、加成、消去、取代反应 | |
| D. | 经测定乙二醇和苯组成的混合物中氧的质量分数为8%,则此混合物中碳的质量分数是84% |
18.下列仪器的使用、实验药品选择或实验现象描述正确的是( )
| A. | 苯、乙醇、四氯化碳都是重要有机溶剂,都可用于提取碘水中的碘单质 | |
| B. | 可用蘸浓硫酸的玻璃棒检验输送氨气的管道是否漏气 | |
| C. | 用量筒量取10.00mL 1.0mol/L的盐酸于100mL容量瓶中,加水稀释至刻度,可制得0.1mol/L的盐酸 | |
| D. | 往装有铁钉的试管中加入2 mL水、3滴稀醋酸和1滴K3[Fe(CN)6]溶液,可以观察到铁钉表面粘附气泡,同时周围出现蓝色沉淀 |
15.下列说法正确的是( )
| A. | 在含有3.6amolHNO3的稀溶液中,加入amolFe粉,反应的离子方程式为5 Fe+4NO3-+16H+=4NO+2Fe3++8H2O+3Fe2+ | |
| B. | 碳酸钠溶液中通入氯气,得到三种钠盐,则反应的离子方程式为Cl2+H2O+2CO32-=ClO-+Cl-+2HCO3- | |
| C. |  分子中所有原子共平面 分子中所有原子共平面 | |
| D. | 肌醇  与葡萄糖的元素组成相同,化学式均为C6H12O6,满足Cm(H2O)n,因此,二者均属于糖类化合物 与葡萄糖的元素组成相同,化学式均为C6H12O6,满足Cm(H2O)n,因此,二者均属于糖类化合物 |