题目内容
“雾霾”已成为当今世界环境热点话题,为减少CO、SO2、NOx等气体的排放,某环境小组研究使用如下方式.
Ⅰ.使用清洁能,例如二甲醚( DME).现由合成气制备二甲醚的主要原理如下:
①CO(g)+2H2(g)?CH3OH(g)△H1=-90.7kJ?mol-1
②2CH3OH(g)?CH3OCH3(g)+H2O(g)△H2=-23.5kJ?mol-1
③CO(g)+H2O(g)?CO2(g)+H2(g)△H3=-41.2kJ?mol-1
回答下列问题:
(1)则反应3H2(g)+3CO(g)?CH3OCH3(g)+CO2(g)的△H= kJ?mol-1.
(2)将合成气以钾
=2通人1L的反应器中,一定条件下发生反应:
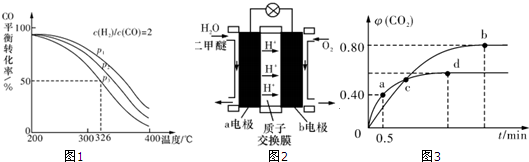
4H2(g)+2CO(g)?CH3 OCH3 (g)+H2 O(g)△H,其CO的平衡转化率随温度、压强变化关系如图1所示,下列说法正确的是 (填字母序号).
A.△H<O
B.P1<P2<p3
C.若在p3和316℃时,起始n(H2)/n( CO)=3,则达到平衡时,CO的转化率小于50%
(3)如图2为绿色“二甲醚燃料电池”的工作原理示意图,a电极的电极反应式为:
Ⅱ.利用I2O5消除CO污染的反应为:5CO(g)+I2O5(s)=5CO2(g)+I2(s);不同温度下,向装有足量I2O5固体的2L恒容密闭容器中通人4mol CO,测得CO2的体积分数φ(CO2)随时间t变化曲
线如图3.请回答:
(1)从反应开始至a点时的反应速率为v(CO) .
(2)b点时化学平衡常数Kb= .
(3)下列说法不正确的是 (填字母序号).
a.容器内气体密度不变,表明反应达到平衡状态
b.两种温度下,c点时体系中混合气体的压强相等
c.增大d点的体系压强,CO的转化率不变
d.b点和d点的化学平衡常数:Kb<Kd.
Ⅰ.使用清洁能,例如二甲醚( DME).现由合成气制备二甲醚的主要原理如下:
①CO(g)+2H2(g)?CH3OH(g)△H1=-90.7kJ?mol-1
②2CH3OH(g)?CH3OCH3(g)+H2O(g)△H2=-23.5kJ?mol-1
③CO(g)+H2O(g)?CO2(g)+H2(g)△H3=-41.2kJ?mol-1
回答下列问题:
(1)则反应3H2(g)+3CO(g)?CH3OCH3(g)+CO2(g)的△H=
(2)将合成气以钾
| n(H2) |
| n(CO) |
4H2(g)+2CO(g)?CH3 OCH3 (g)+H2 O(g)△H,其CO的平衡转化率随温度、压强变化关系如图1所示,下列说法正确的是
A.△H<O
B.P1<P2<p3
C.若在p3和316℃时,起始n(H2)/n( CO)=3,则达到平衡时,CO的转化率小于50%
(3)如图2为绿色“二甲醚燃料电池”的工作原理示意图,a电极的电极反应式为:
Ⅱ.利用I2O5消除CO污染的反应为:5CO(g)+I2O5(s)=5CO2(g)+I2(s);不同温度下,向装有足量I2O5固体的2L恒容密闭容器中通人4mol CO,测得CO2的体积分数φ(CO2)随时间t变化曲
线如图3.请回答:
(1)从反应开始至a点时的反应速率为v(CO)
(2)b点时化学平衡常数Kb=
(3)下列说法不正确的是
a.容器内气体密度不变,表明反应达到平衡状态
b.两种温度下,c点时体系中混合气体的压强相等
c.增大d点的体系压强,CO的转化率不变
d.b点和d点的化学平衡常数:Kb<Kd.

考点:热化学方程式,化学平衡的影响因素,化学平衡的计算
专题:基本概念与基本理论
分析:Ⅰ.(1)依据热化学方程式和盖斯定律计算得到;
(2)A.根据温度对CO的转化率的影响分析;
B.该反应正方向为体积减小的方向,根据压强对CO转化率的影响分析;
C.若在P3和316℃时,起始时
=3,则增大了氢气的量;
(3)酸性条件下,二甲醚失电子生成二氧化碳;
Ⅱ.(1)起始量和a点时CO2的体积分数(即物质量分数),列式计算即可求出从反应开始至a点时的反应速率为v(CO);
(2)根据b点时CO2的体积分数φ(CO2求出平衡浓度[CO]和[CO2]进而求出b点时化学平衡常数Kb;
(3)A.因为条件为恒容,而反应前后气体质量变化,所以容器内气体密度是变量,当不变时表明反应达到平衡状态;
B.c点为交点,各气体物质的量分别相等;
C.I2O5为固体,所以增加投料量对平衡无影响;
D.b点比d点时生成物CO2体积分数大,说明进行的程度大,则化学平衡常数:Kb>Kd.
(2)A.根据温度对CO的转化率的影响分析;
B.该反应正方向为体积减小的方向,根据压强对CO转化率的影响分析;
C.若在P3和316℃时,起始时
| n(H 2) |
| n(CO) |
(3)酸性条件下,二甲醚失电子生成二氧化碳;
Ⅱ.(1)起始量和a点时CO2的体积分数(即物质量分数),列式计算即可求出从反应开始至a点时的反应速率为v(CO);
(2)根据b点时CO2的体积分数φ(CO2求出平衡浓度[CO]和[CO2]进而求出b点时化学平衡常数Kb;
(3)A.因为条件为恒容,而反应前后气体质量变化,所以容器内气体密度是变量,当不变时表明反应达到平衡状态;
B.c点为交点,各气体物质的量分别相等;
C.I2O5为固体,所以增加投料量对平衡无影响;
D.b点比d点时生成物CO2体积分数大,说明进行的程度大,则化学平衡常数:Kb>Kd.
解答:
解:Ⅰ.(1)已知①CO( g)+2H2(g)?CH3OH( g)△H1=-90.7kJ?mol-1,
②2CH30H(g)?CH30CH3(g)+H20(g)△H2=-23.5kJ?mol-1,
③CO(g)+H2O(g)?CO2(g)+H2(g)△H3=-41.2kJ?mol-1,
根据盖斯定律,①×2+②+③得3CO(g)+3H2(g)?CH3OCH3(g)+CO2(g)△H=-246.1kJ?mol-1,
故答案为:-246.1;
(2)A.由图可知随温度升高,CO的转化率降低,说明升高温度平衡逆移,则正方向为放热反应,故△H<0,故A正确;
B.该反应正方向为体积减小的方向,增大压强CO的转化率增大,所以P1>P2>P3,故B错误;
C.若在P3和316℃时,起始时
=3,则增大了氢气的量,增大氢气的浓度,平衡正移,CO的转化率增大,所以CO转化率大于50%,故C错误;
故答案为:A;
(3)酸性条件下,二甲醚在负极失电子生成二氧化碳,其电极反应式为:CH3OCH3-12e-+3H2O=2CO2↑+12H+;
故答案为:CH3OCH3-12e-+3H2O=2CO2↑+12H+;
Ⅱ.(1)a点时:5CO(g)+I2O5(s)?5CO2(g)+I2(s)
起始量/mol 4 0
转化量/mol x x
a点量/mol 4-x x
根据a点时CO2的体积分数φ(CO2)=
=0.40,得x=1.6mol
则从反应开始至a点时的反应速率为v(CO)=
=1.6mol?L-1?min-1,
故答案为:1.6mol?L-1?min-1;
(2)b点时:5CO(g)+I2O5(s)?5CO2(g)+I2(s)
起始量/mol 4 0
转化量/mol y y
b点量/mol 4-y y
根据b点时CO2的体积分数φ(CO2)=
=0.80,得y=3.2mol,[CO]=0.4mol?L-1,[CO2]=1.6mol?L-1
b点时化学平衡常数Kb=
=1024,
故答案为:1024;
(3)a.因为条件为恒容,而反应前后气体质量变化,所以容器内气体密度不变时,表明反应达到平衡状态,故a正确;
b.c点为交点,气体物质的量分别相等,所以两种温度下,体系中混合气体的压强不相等,故b错误;
c.I2O5为固体,所以增加投料量对平衡无影响,CO的转化率不变,故c错误;
d.b点比d点时生成物CO2体积分数大,说明进行的程度大,则化学平衡常数:Kb>Kd,故d错误;
故答案为:bd.
②2CH30H(g)?CH30CH3(g)+H20(g)△H2=-23.5kJ?mol-1,
③CO(g)+H2O(g)?CO2(g)+H2(g)△H3=-41.2kJ?mol-1,
根据盖斯定律,①×2+②+③得3CO(g)+3H2(g)?CH3OCH3(g)+CO2(g)△H=-246.1kJ?mol-1,
故答案为:-246.1;
(2)A.由图可知随温度升高,CO的转化率降低,说明升高温度平衡逆移,则正方向为放热反应,故△H<0,故A正确;
B.该反应正方向为体积减小的方向,增大压强CO的转化率增大,所以P1>P2>P3,故B错误;
C.若在P3和316℃时,起始时
| n(H 2) |
| n(CO) |
故答案为:A;
(3)酸性条件下,二甲醚在负极失电子生成二氧化碳,其电极反应式为:CH3OCH3-12e-+3H2O=2CO2↑+12H+;
故答案为:CH3OCH3-12e-+3H2O=2CO2↑+12H+;
Ⅱ.(1)a点时:5CO(g)+I2O5(s)?5CO2(g)+I2(s)
起始量/mol 4 0
转化量/mol x x
a点量/mol 4-x x
根据a点时CO2的体积分数φ(CO2)=
| x |
| 4 |
则从反应开始至a点时的反应速率为v(CO)=
| ||
| 0.5 |
故答案为:1.6mol?L-1?min-1;
(2)b点时:5CO(g)+I2O5(s)?5CO2(g)+I2(s)
起始量/mol 4 0
转化量/mol y y
b点量/mol 4-y y
根据b点时CO2的体积分数φ(CO2)=
| y |
| 4 |
b点时化学平衡常数Kb=
| [CO2] 5 |
| [CO] 5 |
故答案为:1024;
(3)a.因为条件为恒容,而反应前后气体质量变化,所以容器内气体密度不变时,表明反应达到平衡状态,故a正确;
b.c点为交点,气体物质的量分别相等,所以两种温度下,体系中混合气体的压强不相等,故b错误;
c.I2O5为固体,所以增加投料量对平衡无影响,CO的转化率不变,故c错误;
d.b点比d点时生成物CO2体积分数大,说明进行的程度大,则化学平衡常数:Kb>Kd,故d错误;
故答案为:bd.
点评:本题考查了根据盖斯定律求焓变、速率、平衡、氧化还原反应等问题,综合性较强.

练习册系列答案
 七星图书口算速算天天练系列答案
七星图书口算速算天天练系列答案 初中学业考试导与练系列答案
初中学业考试导与练系列答案
相关题目
生活中碰到的某些问题,常涉及到化学知识,下列分析不正确的是( )
| A、医疗上常用体积分数为70%~75%的酒精作消毒剂 |
| B、用灼烧并闻气味的方法区别纯棉织物和纯毛织物 |
| C、某酸雨样品采集后放置一段时间,pH值变小,是因为水中又溶解了较多的CO2 |
| D、为防止流感传染,可将教室门窗关闭后,用食醋熏蒸,进行消毒 |
25℃时,弱酸的电离平衡常数如表所示,下列说法正确的是( )
| 弱酸 | CH3COOH | HCN | H2CO3 |
| Ka | 1.8×10-5 | 4.9×10-10 | Ka1=4.3×10-7;Ka2=5.6×10-11 |
| A、物质的量浓度相等的三种溶液中,pH大小关系为:pH( NaCN)>pH(Na2 CO3 )pH(CH3COONa) |
| B、amol?L-1 HCN与6 mol?L-1NaOH溶液等体积混合所得的溶液中c(Na+)>c(CN-),则a一定小于b |
| C、向冰醋酸中逐滴加水稀释的过程中,溶液导电能力先增大,后减小 |
| D、将0.1 mol?L-1的Na2 CO3溶液逐滴加入到等浓度的HCN溶液中,无明显现象,说明未反应 |
在一定条件下,分别以高锰酸钾、氯酸钾、过氧化氢为原料制取氧气,当制得同温同压下相同体积的氧气时,三个反应中转移的电子数之比为( )
| A、1:1:2 |
| B、2:2:1 |
| C、2:3:1 |
| D、4:3:2 |
下列有机物中,能发生消去反应生成2种烯烃,又能发生水解反应的是( )
| A、2-溴丁烷 |
| B、3,3-二甲基-2-氯戊烷 |
| C、2,2-二甲基-1-氯丁烷 |
| D、1,3-二氯苯 |
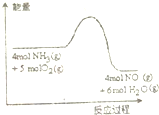 一定条件下密闭容器中发生如图反应:4NH3(g)+5O2(g)?4NO(g)+6H2O(g)反应过程中能量变化如图所示,下列说法正确的是( )
一定条件下密闭容器中发生如图反应:4NH3(g)+5O2(g)?4NO(g)+6H2O(g)反应过程中能量变化如图所示,下列说法正确的是( )| A、降低温度可以加快正反应速率 |
| B、反应体系中加入催化剂可增加反应热 |
| C、降低温度可以提高NH3的转化率 |
| D、增加空气的量可以提高混合气体中NO的体积分数 |
根据表中信息判断,下列选项错误的是( )
| 反应序号 | 反应物 | 产物 |
| ① | KMnO4、H2O2、H2SO4 | K2SO4、MnSO4… |
| ② | Cl2、FeBr2 | FeCl3、FeBr3 |
| ③ | MnO4-… | Cl2、Mn2+… |
| A、反应①的其余产物为H2O和O2 |
| B、反应②中Cl2与FeBr2的物质的量之比为1:2 |
| C、反应③中生成1 mol Cl2,转移电子2 mol |
| D、氧化性由强到弱的顺序为Cl2>MnO4->Br2 |
 下表中所示物质或概念间的从属关系符合如图的是
下表中所示物质或概念间的从属关系符合如图的是