题目内容
【题目】SO2的烟气会形成酸雨,危害环境.利用钠碱循环法可脱除烟气中的SO2 . 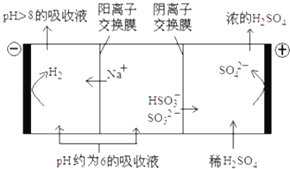
(1)在钠碱循环法中,Na2SO3溶液作为吸收液,可由NaOH溶液吸收SO2制得,该反应的离子方程式是 .
(2)吸收液吸收SO2的过程中,pH随n(SO32﹣),n(HSO3﹣)变化关系如下表:
n(SO32﹣):,n(HSO3﹣) | 91:9 | 1:1 | 1:91 |
PH | 8.2 | 7.2 | 6.2 |
1表判断NaHSO3溶液显性,用化学平衡原理解释:
②当吸收液呈中性时,溶液中离子浓度关系正确的是(选填字母):
a.c(Na﹣)=2c(SO ![]() )+c(HSO
)+c(HSO ![]() )
)
b.c(Na﹣)>c(HSO ![]() )>c(SO
)>c(SO ![]() )>c(H﹣)=c(OH﹣)
)>c(H﹣)=c(OH﹣)
c.c(Na+)+c(H+)=c(SO ![]() )+c(HSO
)+c(HSO ![]() )+c(OH﹣)
)+c(OH﹣)
(3)当吸收液的pH降至约为6时,送至电解槽再生.再生示意图如下:
①HSO3﹣在阳极放电的电极反应式是 .
②当阴极室中溶液PH升至8以上时,吸收液再生并循环利用.简述再生原理: .
【答案】
(1)2OH﹣+SO2=H2O+SO32﹣
(2)酸;HSO3﹣?H++SO32﹣ , 显酸性是因其电离大于其水解;ab
(3)HSO3﹣﹣2e﹣+H2O=SO42﹣+3H+;H+在阴极得电子生成H2 , 溶液中的c(H+)降低,促使HSO3﹣电离生成SO32﹣ , 且Na+进入阴极室,吸收液得以再生
【解析】解:(1.)反应生成亚硫酸钠和水,离子反应为2OH﹣+SO2═SO32﹣+H2O,
故答案为:2OH﹣+SO2═SO32﹣+H2O;
(2.)①由表格中的数据可知,HSO3﹣越多,酸性越强,则电离生成氢离子,电离方程式为HSO3﹣H++SO32﹣ , 显酸性是因其电离大于其水解,
故答案为:酸;HSO3﹣H++SO32﹣ , 显酸性是因其电离大于其水解;②吸收液呈中性时,溶质为亚硫酸钠和亚硫酸氢钠,电离与水解的程度相等,
a.由电荷守恒可知,c(H+)+c(Na+)═2c(SO32﹣)+c(HSO3﹣)+c(OH﹣),中性溶液则c(H+)═c(OH﹣),则c(Na+)═2c(SO32﹣)+c(HSO3﹣),故a正确;
b.SO32﹣+H2OHSO3﹣+OH﹣ , HSO3﹣H++SO32﹣ , 亚硫酸两步水解,则离子浓度为c(Na+)>c(HSO3﹣)>c(SO32﹣)>c(H+)=c(OH﹣),故b正确;
c.c(Na+)+c(H+)═c(SO32﹣)+c(HSO3﹣)+c(OH﹣)中不遵循电荷守恒,故c错误;
故答案为:ab;
(3.)①当吸收液的pH降至约为6时,吸收液中阴离子主要是亚硫酸氢根离子,亚硫酸氢根离子在阳极上失电子和水反应生成硫酸根离子和氢离子,电极反应式为:HSO3﹣+H2O﹣2e﹣=SO42﹣+3H+ ,
故答案为:HSO3﹣﹣2e﹣+H2O=SO42﹣+3H+;②电解时,溶液中阳离子向阴极移动,氢离子在阴极得电子生成氢气,溶液中氢离子浓度降低,导致加速HSO3﹣电离生成SO32﹣ , 钠离子进入阴极室,吸收液就可以再生,
故答案为:H+在阴极得电子生成H2 , 溶液中的c(H+)降低,促使HSO3﹣电离生成SO32﹣ , 且Na+进入阴极室,吸收液得以再生.
(1)二氧化硫与氢氧化钠反应生成亚硫酸钠;(2)①由表格中的数据可知,HSO3﹣越多,酸性越强,则电离生成氢离子;②吸收液呈中性时,溶质为亚硫酸钠和亚硫酸氢钠,电离与水解的程度相等,结合电荷守恒解答;(3)①当吸收液的pH降至约为6时,溶液中阴离子主要为HSO3﹣ , 具有还原性,在阳极上放电发生氧化反应;②当阴极室中溶液pH升至8以上时,阴离子主要为SO32﹣ , 阴极上氢离子得电子发生还原反应,同时生成亚硫酸根离子,溶液中钠离子向阴极移动,导致生成吸收液.

【题目】根据表中信息判断,下列选项不正确的是( )
序号 | 反应物 | 产物 |
① | KMnO4、H2O2、H2SO4 | K2SO4、MnSO4 |
② | Cl2、FeBr2 | FeCl3、FeBr3 |
③ | MnO | Cl2、Mn2+ |
A. 第①组反应的其余产物为H2O和O2
B. 第②组反应中参加反应的Cl2与FeBr2的物质的量之比为1∶2
C. 第③组反应中生成1 mol Cl2,转移电子 2 mol
D. 氧化性由强到弱顺序为MnO![]() >Cl2>Fe3+>Br2
>Cl2>Fe3+>Br2
