题目内容
4.1 mol某链烃最多能和2 mol氯化氢发生加成反应,生成氯代烷1 mol,该氯代烷能和6 mol氯气发生取代反应,生成只含碳元素和氯元素的氯代烃,该烃可能是( )| A. | 丙烯 | B. | 丙炔 | C. | 1-丁炔 | D. | 1,3-丁二烯 |
分析 根据1mol某链烃最多能和2molHCl发生加成反应,则分子中含有2个C=C键或1个C≡C,1mol该卤代烷能和6molCl2发生取代反应,说明1个卤代烷中引入6个Cl原子,加成时1个某链烃分子已引入2个Cl原子形成卤代烷,所以1个最后的有机化合物中分子共含有8个Cl原子,以此来解答.
解答 解:1mol某链烃最多能和2molHCl发生加成反应,则分子中含有2个C=C键或1个C≡C,1个某链烃分子已引入2个Cl原子形成卤代烷;1mol该卤代烷能和6molCl2发生取代反应,说明1个卤代烷中引入6个Cl原子,所以最后的有机化合物1个分子含有8个Cl原子,则C原子数目为3,故该烃的分子式为为C3H4,为丙炔,故选B.
点评 本题考查有机物的推断,明确加成反应与取代反应的实质是解答本题的关键,注意1mol该卤代烷能和6molCl2发生取代反应,说明1个卤代烷中引入6个Cl原子.

练习册系列答案
 一课一练课时达标系列答案
一课一练课时达标系列答案
相关题目
14.25℃时有关弱酸的电离平衡常数关系为:Ki(CH3COOH)>Ki1(H2CO3)>Ki(HCN)>Ki2(H2CO3).在冰醋酸中逐滴加水,溶液导电性和加水体积的关系如图所示.下列说法正确的是( )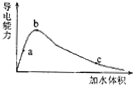

| A. | 等物质的量浓度的各溶液pH关系为:pH(Na2CO3)>pH(NaCN)>pH(CH3COONa) | |
| B. | 冰醋酸中逐滴加水,则溶液的导电性、醋酸的电离程度、pH均先增大后减小 | |
| C. | 混合溶液中含有等物质的量的Na2CO3和NaHCO3,则一定存在c(Na+)+c(H+)═c(OH-)+c(HCO3-)+2c(CO32-) | |
| D. | a mol/LHCN溶液与b mol/LNaOH溶液等体积混合后,所得溶液中c(Na+)>c(CN-),则b一定大于a |
15.用NA表示阿伏加德罗常数的值,下列叙述正确的是( )
| A. | 标准状况下,2.24 L F2所含原子数为0.1NA | |
| B. | 4.4gCO2中氧分子的个数为0.1NA | |
| C. | 78g Na2O2固体中Na+的个数目为NA | |
| D. | 2.3gNa完全燃烧后失去电子的个数为0.1NA |
19.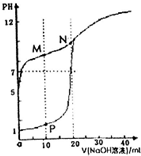 用0.1mol•L-1NaOH溶液分别滴定体积均为20mL、浓度均为0.1mol•L-1HCl溶液和HX溶液,溶液的pH随加入的NaOH溶液体积变化如图.下列说法不正确的是( )
用0.1mol•L-1NaOH溶液分别滴定体积均为20mL、浓度均为0.1mol•L-1HCl溶液和HX溶液,溶液的pH随加入的NaOH溶液体积变化如图.下列说法不正确的是( )
 用0.1mol•L-1NaOH溶液分别滴定体积均为20mL、浓度均为0.1mol•L-1HCl溶液和HX溶液,溶液的pH随加入的NaOH溶液体积变化如图.下列说法不正确的是( )
用0.1mol•L-1NaOH溶液分别滴定体积均为20mL、浓度均为0.1mol•L-1HCl溶液和HX溶液,溶液的pH随加入的NaOH溶液体积变化如图.下列说法不正确的是( )| A. | NaX溶液呈碱性 | B. | P点:c(Na+)>c(H+) | ||
| C. | M点:c(HX)+c(X-)=2c(Na+) | D. | M点水电离程度小于N点 |
9.分析下列各项结构的规律,按此规律排布第8项的分子式应为( )
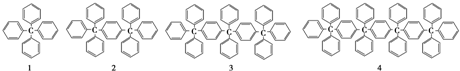

| A. | C158H118 | B. | C158H116 | C. | C160H116 | D. | C160H118 |
16.下列各项表述正确的是( )
| A. | 水分子的结构式是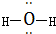 | |
| B. | NaCl的电子式为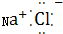 | |
| C. | 23Na37Cl中质子数和中子数之比是7:8 | |
| D. | 三氟化氮的电子式为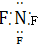 |
14.向饱和澄清石灰水中加入生石灰,再恢复到原温度,下列说法正确的是( )
| A. | Ca2+浓度减小 | B. | 溶剂质量减小 | C. | 溶液质量不变 | D. | Ca2+数目增多 |
 .
.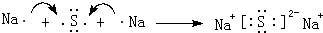 .
.