题目内容
18.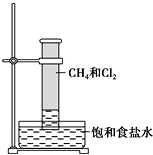 某课外活动小组利用如图所示装置探究甲烷与氯气的反应.根据题意,回答下列问题:
某课外活动小组利用如图所示装置探究甲烷与氯气的反应.根据题意,回答下列问题:①CH4与Cl2发生反应的条件是光照;若用日光直射,可能会引起爆炸.
②实验中可观察的实验现象有:量筒内壁出现油状液滴,试管内有少量白雾产生,量筒内黄绿色气体颜色变浅,量筒内液面上升等.
③实验中生成的油状液滴的化学式为CH2Cl2、CHCl3、CCl4,其中CHCl3、CCl4是工业上重要的溶剂.
④用饱和食盐水而不用水的原因是降低Cl2在水中溶解度,抑制Cl2和水的反应.
分析 ①甲烷为饱和烷烃,在光照条件下能够与氯气发生取代反应,若用日光直射,可能会引起爆炸;
②甲烷发生取代反应生成氯化氢,氯气消耗所以量筒内颜色变浅,气体减少所以压强减小,量筒内的压强减小,量筒内液面上升.因生成的HCl易溶于水,溶液中Cl-浓度增大,使氯化钠的溶解平衡逆向移动,反应生成CH2Cl2、CHCl3、CCl4常温下是无色油液体;
③反应生成CH2Cl2、CHCl3、CCl4常温下是无色油液体,CCl4是工业上重要的溶剂;
④氯气在饱和食盐水中的溶解度降低.
解答 解:①CH4和Cl2在光照条件下发生反应,若用日光直射,反应非常剧烈,可能会引起爆炸;
故答案为:光照;爆炸;
②甲烷发生取代反应生成氯化氢,氯气消耗所以量筒内颜色变浅,气体减少所以压强减小,量筒内的压强减小,量筒内液面上升.因生成的HCl易溶于水,溶液中Cl-浓度增大,使氯化钠的溶解平衡逆向移动,反应生成CH2Cl2、CHCl3、CCl4常温下是无色油液体,所以看到的现象有:量筒内壁出现油状液滴,饱和食盐水中有少量固体析出,量筒内黄绿色气体颜色变浅,量筒内液面上升;
故答案为:量筒内黄绿色气体颜色变浅,量筒内液面上升;
③反应生成CH2Cl2、CHCl3、CCl4常温下是无色油液体,所以实验中生成的油状液滴的化学式为CH2Cl2、CHCl3、CCl4,CHCl3、CCl4是工业上重要的溶剂;
故答案为:CH2Cl2、CHCl3、CCl4,CHCl3、CCl4;
④氯气在饱和食盐水中的溶解度降低,所以用饱和食盐水而不用水的原因是降低Cl2在水中溶解度,抑制Cl2和水的反应;
故答案为:降低Cl2在水中溶解度,抑制Cl2和水的反应.
点评 本题考查了甲烷的性质,熟悉甲烷的结构是解题关键,注意(3)为易错选项,抓住物质的性质是解题关键.

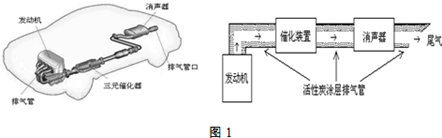
(1)汽车发动机工作时会引发N2(g)+O2(g)=2NO(g)△H=+180kJ•mol-1,其能量变化示意图如下:
则NO中氮氧键的键能为632kJ•mol-1;
(2)空燃比过小易产生CO.有人提出可以设计反应2CO(g)=2C(s)+O2(g)来消除CO的污染.判断该设想是否可行,并说出理由不合理,该反应焓增、熵减,任何条件下都不能自发进行或该反应△H>0,△S<0 则△G>0;
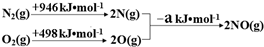
(3)利用活性炭涂层排气管处理NOx的反应为:xC(s)+2NOx(g)?N2(g)+xCO2 (g)△H=-b kJ•mol-1.若使NOx更加有效的转化为无毒尾气排放,以下措施理论上可行的是AD;
A.增加排气管长度 B.增大尾气排放口
C.升高排气管温度 D.添加合适的催化剂
(4)催化装置中涉及的反应之一为:2NO(g)+2CO(g)?N2(g)+2CO2(g).
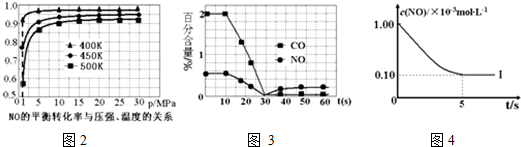
①探究上述反应中NO的平衡转化率与压强、温度的关系,得到图2所示的曲线.催化装置比较适合的温度和压强是400K,1MPa;
②测试某型号汽车在冷启动(冷启动指发动机水温低的情况下启动)时催化装置内CO和NO百分含量随时间变化曲线如图3所示.则前10s 内,CO和NO百分含量没明显变化的原因是尚未达到催化剂工作温度(或尚未达到反应的温度);
③研究表明:在使用等质量催化剂时,增大催化剂比表面积可提高化学反应速率.为了分别验证温度、催化剂比表面积对化学反应速率的影响规律,某同学设计了以下三组实验:
| 实验编号 | T(K) | NO初始浓度 (mol•L-1) | CO初始浓度 (mol•L-1) | 催化剂的比表面积(m2/g) |
| Ⅰ | 400 | 1.00×10-3 | 3.60×10-3 | 82 |
| Ⅱ | 400 | 1.00×10-3 | 3.60×10-3 | 124 |
| Ⅲ | 450 | 1.00×10-3 | 3.60×10-3 | 124 |
| A. | 麻的主要成分表示为(C6H1206) | |
| B. | 丝的主要成分是蛋白质 | |
| C. | 麻和丝生要成分均属于高分子化合物 | |
| D. | 麻和丝可以通过灼烧进行区分 |
| A. | CH4和 H2O | B. | SiC和 HCl | C. | Ar和Si | D. | SiO2 和 CO2 |
| A. | 混合气体密度恒定不变 | B. | 混合气体的颜色不再改变 | ||
| C. | H2、I2、HI 的浓度相同 | D. | I2在混合气体中体积分数不变 |