题目内容
13.设NA为阿伏伽德罗常数的值.下列说法正确的是( )| A. | 铝与氢氧化钠溶液反应生成67.2LH2时,转移的电子数为9NA | |
| B. | 2L0.5mol/L醋酸钠溶液中含CH3COO-个数小于NA | |
| C. | 28gCO和C2H4的混合气体中含有的碳原子总数为1.5NA | |
| D. | 2molSO2与2molO2在密闭容器中充分反应后,容器内的气体分子数为3NA |
分析 A、氢气所处的状态不明确;
B、醋酸钠为强酸弱碱盐,在溶液中会水解;
C、CO和乙烯的摩尔质量均为28g/mol,但CO中含1个碳原子,乙烯中含2个碳原子;
D、二氧化硫和氧气的反应为可逆反应.
解答 解:A、氢气所处的状态不明确,故其物质的量无法计算,则反应转移的电子数无法计算,故A错误;
B、醋酸钠为强碱弱酸盐,醋酸根为弱酸根,在溶液中会水解,故溶液中的醋酸根的个数小于NA个,故B正确;
C、CO和乙烯的摩尔质量均为28g/mol,故28g混合物的物质的量为1mol,但CO中含1个碳原子,乙烯中含2个碳原子,故1molCO和乙烯的混合物中含有的碳原子数介于NA到2NA之间,但不一定是1.5NA个,故C错误;
D、二氧化硫和氧气的反应为可逆反应,不能进行彻底,故溶液中的分子个数多于3NA个,故D错误.
故选B.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
相关题目
3.下列说法正确的是( )
| A. | 原子最外层电子数为2的元素一定处于周期表ⅡA族 | |
| B. | 主族元素X、Y能形成XY2型化合物,则X与Y的原子序数之差可能为2或5 | |
| C. | 氯化氢的沸点比氟化氢的沸点高 | |
| D. | 同主族元素形成的氧化物的晶体类型均相同 |
4.下列各种反应类型中,后者一定包含前者的是( )
| A. | 分解复分解 | B. | 氧化化合 | C. | 复分解中和 | D. | 置换氧化还原 |
18.NH3和纯净的O2在一定条件下发生反应:4NH3(g)+3O2(g)?2N2(g)+6H2O(g),现向一容积不变的2L密闭容器中充入4mol NH3和3mol O2,4min后,测得生成的H2O占混合气体体积的40%,则下列表示此段时间内该反应的平均速率不正确的是( )
| A. | v(O2)=0.225 mol•L-1min-1 | B. | v(H2O)=0.375 mol•L-1min-1 | ||
| C. | v(N2)=0.125 mol•L-1min-1 | D. | v(NH3)=0.250 mol•L-1min-1 |
5.向体积均为10mL且物质的量浓度相同的两份NaOH溶液中分别通入一定量的CO2得到溶液甲和乙;向甲、乙两溶液中分别滴加0.1mol•L-1盐酸,此时反应生成CO2体积(标准状况)与所加盐酸体积间的关系如图所示.则下列叙述中正确的是( )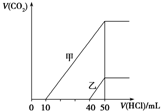

| A. | 原NaOH溶液的物质的量浓度为0.5 mol•L-1 | |
| B. | 当0<V(HCl)<10 mL时,甲溶液中发生反应的离子方程式为:OH-+H+═H2O | |
| C. | 乙溶液中含有的溶质是NaOH、NaHCO3 | |
| D. | 乙溶液中滴加盐酸后产生CO2体积的最大值为112 mL(标准状况) |
2.最近据央视报道,专家选取了我国黑龙江、江西、福建等12个省、市、自治区,采集各种主副食品的烹调方法和食谱,进行了科学细致的检测,结果发现有四成的食品铝含量超过国家标准2到9倍.下列说法中正确的是( )
| A. | 铝的导热性能较好,应大力提倡用铝炊具 | |
| B. | 铝制器具不宜盛放食品较长时间(如放入冰箱中过夜等) | |
| C. | 明矾可用于饮用水的杀菌消毒 | |
| D. | 小孩可以食用含铝较多的食物 |
19.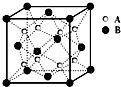 某晶体中晶体结构最小的重复单元如图:A在正方体内,B分别在顶点和面心,则该晶体的化学式为( )
某晶体中晶体结构最小的重复单元如图:A在正方体内,B分别在顶点和面心,则该晶体的化学式为( )
 某晶体中晶体结构最小的重复单元如图:A在正方体内,B分别在顶点和面心,则该晶体的化学式为( )
某晶体中晶体结构最小的重复单元如图:A在正方体内,B分别在顶点和面心,则该晶体的化学式为( )| A. | B2A | B. | BA2 | C. | B7A4 | D. | B4A7 |
 将CH4设计成燃料电池,其利用率更高,装置如图所示(A、B为多孔性碳棒)持续通入甲烷,在标准状况下,消耗甲烷体积VL.完成下列问题:
将CH4设计成燃料电池,其利用率更高,装置如图所示(A、B为多孔性碳棒)持续通入甲烷,在标准状况下,消耗甲烷体积VL.完成下列问题: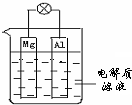 如图所示,组成一种原电池.试回答下列问题(灯泡功率合适):
如图所示,组成一种原电池.试回答下列问题(灯泡功率合适):