题目内容
CO(g)+H2O(g)

CO2(g)+H2(g)△H<0在温度t1时达到平衡,c1(CO)=c1(H2O)=1.0mol/L,其平衡常数为K1.升高反应体系的温度至t2时,反应物的平衡浓度分别为c2(CO)和c2(H2O),平衡常数为K2,则( )

CO2(g)+H2(g)△H<0在温度t1时达到平衡,c1(CO)=c1(H2O)=1.0mol/L,其平衡常数为K1.升高反应体系的温度至t2时,反应物的平衡浓度分别为c2(CO)和c2(H2O),平衡常数为K2,则( )
| A.c2(CO)<c2(H2O) |
| B.c1(CO)>c2(CO) |
| C.K2和K1的单位均为mol/L |
| D.K2<K1 |
依据化学平衡CO(g)+H2O(g)

CO2(g)+H2(g)△H<0,正向反应是放热反应.所以温度升高,平衡向吸热反应方向进行,即平衡逆向进行;
A、t1时达到平衡,c1(CO)=c1(H2O)=1.0mol/L,所以新平衡状态下,c2(CO)和c2(H2O)仍相同;故A错误;
B、升高反应体系的温度至t2时,平衡逆向进行,所以c2(CO)>c1(CO),故B错误;
C、据平衡常数的计算式可知;K=
,平衡常数的单位为1,故C错误;
D、升高反应体系的温度至t2时,正向反应是放热反应.所以温度升高,平衡向吸热反应方向进行,即平衡逆向进行,K2<K1,故D正确;
故选D.

CO2(g)+H2(g)△H<0,正向反应是放热反应.所以温度升高,平衡向吸热反应方向进行,即平衡逆向进行;
A、t1时达到平衡,c1(CO)=c1(H2O)=1.0mol/L,所以新平衡状态下,c2(CO)和c2(H2O)仍相同;故A错误;
B、升高反应体系的温度至t2时,平衡逆向进行,所以c2(CO)>c1(CO),故B错误;
C、据平衡常数的计算式可知;K=
| [CO2][H2] |
| [CO][]H2O] |
D、升高反应体系的温度至t2时,正向反应是放热反应.所以温度升高,平衡向吸热反应方向进行,即平衡逆向进行,K2<K1,故D正确;
故选D.

练习册系列答案
 全能闯关100分系列答案
全能闯关100分系列答案
相关题目
已知:①CO(g)+
O2(g)═CO2(g)△H=-283.0kJ?mol-1②H2(g)+
O2(g)═H2O(g)△H=-241.8kJ?mol-1,则CO(g)+H2O(g)═H2(g)+CO2(g)的△H为( )
| 1 |
| 2 |
| 1 |
| 2 |
| A、+41.2 kJ?mol-1 |
| B、-41.2 kJ?mol-1 |
| C、+82.4kJ?mol-1 |
| D、-524.8 kJ?mol-1 |
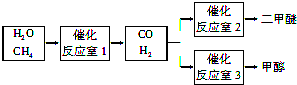
 美国Bay等工厂使用石油热裂解的副产物甲烷来制取氢气,其生产流程如图1:
美国Bay等工厂使用石油热裂解的副产物甲烷来制取氢气,其生产流程如图1: