题目内容
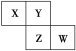
【题目】下列反应中,产物中只能生成铁的+3价化合物的是
A.少量铁与稀硫酸反应
B.铁丝在氧气中燃烧
C.少量FeCl2溶液中通入过量氯气
D.Fe投入到CuSO4溶液中
【答案】C
【解析】
A. 少量铁与稀硫酸反应,生成FeSO4等,A不合题意;
B. 铁丝在氧气中燃烧,生成Fe3O4等,B不合题意;
C. 少量FeCl2溶液中通入过量氯气,生成FeCl3,C符合题意;
D. Fe投入到CuSO4溶液中,生成FeSO4等,D不合题意。
故选C。

 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案【题目】柠檬酸亚铁(FeC6H6O7)是一种易吸收的高效铁制剂,可由绿矾(FeSO4·7H2O)通过下列反应制备:FeSO4+Na2CO3===FeCO3↓+Na2SO4 FeCO3 +C6H8O7=FeC6H6O7+CO2↑+H2O
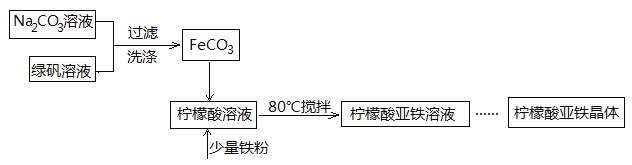
(1)生成的FeCO3沉淀需经充分洗涤,检验洗涤是否完全的方法是____________________。
(2)将制得的FeCO3加入到足量柠檬酸溶液中,再加入少量铁粉,80℃下搅拌反应。
①铁粉的作用是_________________。
②反应结束后,无需过滤,除去过量铁粉的方法是_____________。
(3)最后溶液经浓缩、加入适量无水乙醇、静置、过滤、洗涤、干燥,获得柠檬酸亚铁晶体。分离过程中加入无水乙醇的目的是________________。
(4)某研究性学习小组欲从硫铁矿烧渣(主要成分为Fe2O3、SiO2、Al2O3 ) 出发,先制备绿矾,再合成柠檬酸亚铁。请结合下图的绿矾溶解度曲线,补充完整由硫铁矿烧渣制备FeSO4·7H2O晶体的实验步骤(可选用的试剂:铁粉、稀硫酸和NaOH溶液):
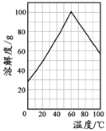
①向一定量烧渣中加入足量的稀硫酸充分反应,过滤
②向滤液中滴加过量的NaOH溶液,过滤,充分洗涤固体
③向固体中加入足量稀硫酸至固体完全溶解
④再加入足量的铁粉,充分搅拌后,过滤得到FeSO4 溶液
⑤_______________________________________________,得到FeSO4·7H2O 晶体。
(5)取25.00g柠檬酸亚铁晶体(摩尔质量为246g/mol),配成100mL溶液,取20.00mL至锥形瓶中,另取0.2000mol.L-1的酸性KMnO4标准溶液装入酸式滴定管中,用氧化还原法测定柠檬酸亚铁晶体的质量分数,杂质不与酸性KMnO4标准溶液反应,经4次滴定,每次消耗KMnO4溶液的体积如下:
实验序号 | 1 | 2 | 3 | 4 |
消耗KMnO4溶液体积 | 20.00mL | 19.98mL | 21.38mL | 20.02mL |
滴定终点时现象为:__________________________________柠檬酸亚铁的质量分数________________