题目内容
10.提出元素周期律并绘制了第一个元素周期表的科学家是( )| A. | 侯德榜 | B. | 门捷列夫 | C. | 阿伏加德罗 | D. | 道尔顿 |
分析 1869年,俄国化学家门捷列夫发现了元素周期律,并编制出元素周期表,使得化学学习和研究变得有规律可循.
解答 解:A.侯德榜发明了侯氏制碱法,故A错误;
B.俄国化学家门捷列夫发现了元素周期律,并编制出元素周期表,故B正确;
C.阿佛加德罗提出了分子学说,故C错误;
D.道尔顿提出了近代原子学说,故D错误.
故选B.
点评 本题主要考查了化学史,难度不大,平时注意知识的积累.

练习册系列答案
相关题目
5.常温下,下列各组离子在指定溶液中一定能大量共存的是( )
| A. | $\frac{{K}_{w}}{c({H}^{+})}$=0.1的溶液中:Na+、K+、SiO32-、SO32- | |
| B. | pH=1的溶液中:K+、Al3+、SO42-、F- | |
| C. | 与镁反应生成氢气的溶液中:Na+、Ba2+、NO3-、Cl- | |
| D. | 0.1mol/L的NaHCO3溶液中:NH4+、Mg2+、Br-、AlO2- |
1.图是在一容器中某个化学反应前、后物质的微观模拟图,则下列说法正确的是( )
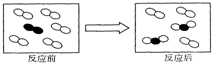

| A. | 反应前容器中的物质为单质 | |
| B. | 反应后容器中的物质为化合物 | |
| C. | 该反应为化合反应 | |
| D. | 该反应由两种反应物反应生成两种生成物 |
5.已知 X、Y、Z、Q、R、E六种元素中,原子序数X<Y<Z<Q<R<E,其结构或性质信息如下表.
请根据信息回答有关问题:
(1)元素Y的原子核外共有7种不同运动状态的电子,有3种不同能级的电子.
(2)X、Y、Z三种元素的电负性由高到低的排列次序依次为(写元素符号)O>N>C.
(3)X、Z元素均表现最低化合价时的氢化物中,沸点由高到低的排列次序为(写化学式)H2O>CH4.
(4)R的最高化合价为+6.R的一种配合物的化学式为RCl3•6H2O.已知0.01molRCl3•6H2O在水溶液中用过量硝酸银溶液处理,产生0.02mol AgCl沉淀.此配合物最可能是B.
A.[R(H2O)6]Cl3 B.[R(H2O)5Cl]Cl2•H2O
C.[R(H2O)4Cl2]Cl•2H2O D.[R(H2O)3Cl3]•3H2O
(5)元素E能形成八面体构型的配合物离子[E (YH3)xQ2]+,该配合物离子为(写化学式)[Co (NH3)4Cl2]+.
(6)Y的最低价氢化物与Z的一种氢化物反应,生成的两种产物均不污染环境,其反应的化学方程式为2NH3+3H2O2=N2+6H2O.
| 元素 | 结构或性质信息 |
| X | 原子的L层上s电子数等于p电子数. |
| Y | 原子核外的L层有3个未成对电子. |
| Z | 在元素周期表的各元素中电负性仅小于氟. |
| Q | 单质常温、常压下是气体,原子的M层上有1个未成对的p电子. |
| R | 核电荷数是Y与Q的核电荷数之和 |
| E | 原子序数比R大3 |
(1)元素Y的原子核外共有7种不同运动状态的电子,有3种不同能级的电子.
(2)X、Y、Z三种元素的电负性由高到低的排列次序依次为(写元素符号)O>N>C.
(3)X、Z元素均表现最低化合价时的氢化物中,沸点由高到低的排列次序为(写化学式)H2O>CH4.
(4)R的最高化合价为+6.R的一种配合物的化学式为RCl3•6H2O.已知0.01molRCl3•6H2O在水溶液中用过量硝酸银溶液处理,产生0.02mol AgCl沉淀.此配合物最可能是B.
A.[R(H2O)6]Cl3 B.[R(H2O)5Cl]Cl2•H2O
C.[R(H2O)4Cl2]Cl•2H2O D.[R(H2O)3Cl3]•3H2O
(5)元素E能形成八面体构型的配合物离子[E (YH3)xQ2]+,该配合物离子为(写化学式)[Co (NH3)4Cl2]+.
(6)Y的最低价氢化物与Z的一种氢化物反应,生成的两种产物均不污染环境,其反应的化学方程式为2NH3+3H2O2=N2+6H2O.
15. 胡椒酚是植物挥发油中的一种成分,其结构简式如图.关于胡椒酚的下列说法:
胡椒酚是植物挥发油中的一种成分,其结构简式如图.关于胡椒酚的下列说法:
①该化合物属于芳香烃;②分子中至少有7个碳原子处于同一平面;
③它的部分同分异构体能发生银镜反应;
④该化合物的化学式为C9H11O.其中正确的是( )
 胡椒酚是植物挥发油中的一种成分,其结构简式如图.关于胡椒酚的下列说法:
胡椒酚是植物挥发油中的一种成分,其结构简式如图.关于胡椒酚的下列说法:①该化合物属于芳香烃;②分子中至少有7个碳原子处于同一平面;
③它的部分同分异构体能发生银镜反应;
④该化合物的化学式为C9H11O.其中正确的是( )
| A. | ①③ | B. | ①②④ | C. | ②③④ | D. | ②③ |
2.下列关于物质结构的说法中正确的是( )
| A. | BF3、HClO分子中所有原子都满足最外层8电子结构 | |
| B. | 某元素原子最外层电子数是次外层电子数的a(a为整数)倍,则该原子核内质子数为2a+2 | |
| C. | D2O分子与H2O分子是所含电子总数不相等的分子 | |
| D. | 在任何物质分子中都含有化学键 |
19.通常人们把拆开1mol某化学键吸收的能量看成该化学键的键能.键能的大小可以衡量化学键的强弱,也可以估计化学反应的反应热(△H),化学反应的△H等于反应中断裂旧化学键的键能之和与反应中形成新化学键的键能之和的差.下列是一些化学键的键能
根据键能数据估算下列反应的反应热△H为:CH4 (g)+4F2 (g)═CF4(g)+4HF(g)( )
| 化学键 | C-H | C-F | H-F | F-F |
| 键能/(kJ•mol-1) | 414 | 489 | 565 | 155 |
| A. | -1940 kJ•mol-1 | B. | 1940 kJ•mol-1 | C. | -485 kJ•mol-1 | D. | 485 kJ•mol-1 |
20.下列实验操作正确的是( )
| A. | 在蔗糖与稀硫酸共热后的溶液中,滴加银氨溶液,验证产物中的葡萄糖 | |
| B. | 淀粉中加入98%的硫酸溶液,在酒精灯上加热,使其水解 | |
| C. | 棉花中加入90%的硫酸,并用玻璃棒把棉花捣烂,在酒精灯上直接加热使其水解 | |
| D. | 向淀粉水解后的溶液中加入碘水,溶液变蓝,证明淀粉尚未水解 |