题目内容
【题目】海洋约占地球表面积的71%,海水资源的利用前景广阔,从海水中提取镁的主要步骤如图所示,下列说法正确的是
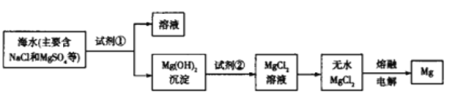
A.工业上利用NaOH溶液使Mg2+转化为Mg(OH)2
B.与Mg同周期的金属都可以采用电解熔融的无水氯化物来制备
C.试剂②可以选用盐酸
D.工业上也可以将Mg(OH)2煅烧分解为MgO,通过电解熔融MgO制取Mg
【答案】C
【解析】
海水中加入试剂①石灰乳沉淀镁离子生成氢氧化镁沉淀,通过过滤得到氢氧化镁沉淀,加入试剂②为盐酸溶解生成氯化镁溶液,通过蒸发结晶得到氯化镁晶体,氯化氢气流中的环境加热失去结晶水得到固体氯化镁,电解熔融氯化镁得到镁和氯气。
A.石灰乳比NaOH成本更低,工业上利用试剂①石灰乳使Mg2+转化为Mg(OH)2,故A错误;
B.与Mg同周期的金属铝不能采用电解熔融的无水氯化物来制备,氯化铝是共价化合物,熔融状态不导电,故B错误;
C.试剂②可以选用盐酸,溶解氢氧化镁生成氯化镁溶液,故C正确;
D.MgO熔点高,熔化耗能太多,工业上不用“将Mg(OH)2煅烧分解为MgO,电解熔融MgO制取Mg”,故D错误;
故选C。

【题目】某小组以4H++4I-+O2=2I2+2H2O为研究对象,探究影响氧化还原反应因素。
实验 | 气体a | 编号及现象 |
| HCl | Ⅰ.溶液迅速呈黄色 |
SO2 | Ⅱ.溶液较快呈亮黄色 | |
CO2 | Ⅲ.长时间后,溶液呈很浅的黄色 | |
空气 | Ⅳ.长时间后,溶液无明显变化 |
(1)实验Ⅳ的作用是______________。用CCl4萃取Ⅰ、Ⅱ、Ⅲ、Ⅳ的溶液,萃取后下层CCl4的颜色均无明显变化。
(2)取萃取后上层溶液,用淀粉检验:Ⅰ、Ⅲ的溶液变蓝;Ⅱ、Ⅳ的溶液未变蓝。溶液变蓝说明Ⅰ、Ⅲ中生成了______________。
(3)查阅资料:I2易溶于KI溶液。下列实验证实了该结论并解释Ⅰ、Ⅲ的萃取现象。
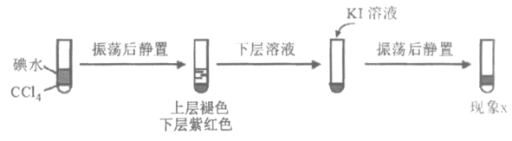
现象x是______________。
(4)针对Ⅱ中溶液未检出I2的原因,提出三种假设:
假设1:溶液中c(H+)较小。小组同学认为此假设不成立,依据是______________。
假设2:O2只氧化了SO2,化学方程式是______________。
假设3:I2不能在此溶液中存在。
(5)设计下列实验,验证了假设3,并继续探究影响氧化还原反应的因素。
i.取Ⅱ中亮黄色溶液,滴入品红,红色褪去。
ii.取Ⅱ中亮黄色溶液,加热,黄色褪去,经品红检验无SO2。加入酸化的AgNO3溶液,产生大量AgI沉淀,长时间静置,沉淀无明显变化。
iii.取Ⅱ中亮黄色溶液,控制一定电压和时间进行电解,结果如下。
电解时间/min | 溶液 | 阳极 | 阴极 |
t1 | 黄色变浅、有少量SO42- | 检出I2,振荡后消失 | H2 |
| 溶液无色、有大量SO42- | 检出I2,振荡后消失 | H2 |
结合化学反应,解释上表中的现象:______________。
(6)综合实验证据说明影响I-被氧化的因素及对应关系______________。
【题目】某同学用标准![]() 溶液来测定未知浓度的盐酸的浓度:
溶液来测定未知浓度的盐酸的浓度:
(1)配制250mL 0.5mol/L的![]() 溶液所需的玻璃仪器为________________________。
溶液所需的玻璃仪器为________________________。
(2)用滴定管准确量取20.00mL未知浓度的盐酸于锥形瓶中,加入酚酞作指示剂,用![]() 溶液滴定到终点。
溶液滴定到终点。
该同学进行了三次实验,实验数据如下表:
实验编号 | 盐酸的体积(mL) | 标准 |
1 | 20.00 | 18.20 |
2 | 17.10 | |
3 | 16.90 |
滴定中误差较大的是第______次实验,造成这种误差的可能原因是______(填选项编号)
a、在盛装未知浓度的盐酸之前锥形瓶里面有少量蒸馏水,未烘干
b、滴定管在盛装标准![]() 溶液前未润洗
溶液前未润洗
c、滴定开始前盛装标准![]() 溶液的滴定管尖嘴部分有气泡,滴定终点读数时未发现气泡
溶液的滴定管尖嘴部分有气泡,滴定终点读数时未发现气泡
d、滴定开始前盛装标准![]() 溶液的滴定管尖嘴部分没有气泡,在滴定终点读数时发现尖嘴部分有气泡
溶液的滴定管尖嘴部分没有气泡,在滴定终点读数时发现尖嘴部分有气泡
e、滴定过程中,锥形瓶摇荡得太剧烈,以致有些液滴飞溅出来
f、达到滴定终点时,俯视溶液凹液面最低点读数
g、滴定到终点时,溶液颜色由无色变到了红色
(3)该同学所测得盐酸的物质的量浓度为______________________(结果保留三位小数)。