题目内容
7.物质氧化性、还原性的强弱,不仅与物质的结构有关,还与物质的浓度和反应温度有关.下列各组物质:①Cu与HNO3溶液
②Cu与FeCl3溶液
③Zn与H2SO4溶液
④Fe与HCl溶液
⑤O2与Na,由于浓度不同而发生不同氧化还原反应的是( )
| A. | ①③ | B. | ③⑤ | C. | ①②⑤ | D. | ①③⑤ |
分析 硝酸、硫酸的浓度不同,性质不同,与金属发生反应时,发生不同的氧化还原反应,以此解答该题.
解答 解:①Cu与HNO3溶液中,若为浓硝酸,发生Cu+4HNO3═Cu(NO3)2+2NO2↑+2H2O,若为稀硝酸,则发生3Cu+8HNO3═3Cu(NO3)2+2NO↑+4H2O,故正确;
②Cu与FeCl3溶液中,无论浓度大小都只发生Cu+2FeCl3═2FeCl2+CuCl2,故错误;
③Zn与H2SO4溶液中,若为稀硫酸,发生Zn+H2SO4═ZnSO4+H2↑,若为浓硫酸,则发生Zn+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$ZnSO4+SO2↑+2H2O,故正确;
④Fe与HCl溶液中,无论浓度大小都只发生Fe+2HCl=FeCl2+H2↑,故错误.
⑤Na和O2加热生成过氧化钠,不加热生成氧化钠,所以受温度的影响,故错误;
故选A.
点评 本题考查常见物质的性质,明确浓稀硝酸、浓硫酸具有强氧化性及发生的化学反应是解答本题的关键,注意相关方程式的书写,难度中等.

练习册系列答案
 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案
相关题目
1.下列实验方案、现象与实验结论不正确的是( )
| 选项 | 实验操作及现象 | 实验结论 |
| A | 向Fe(NO3)3溶液中通入SO2,滴加BaCl2溶液; 产生白色沉淀 | NO3-在酸性条件下能氧化SO2生成SO42- |
| B | 向Fe(NO3)2溶液中滴加少量盐酸; 浅绿色变深绿色 | 溶液中存在Fe2+水解平衡移动 |
| C | 向沸水中滴加FeCl3饱和溶液,煮沸得红褐色液体;用激光灯照射液体,有一条明亮“通路” | 该液体分散质直径介于1nm与100nm之间 |
| D | 向FeI2溶液中滴加酸化的双氧水和淀粉溶液;溶液为蓝色 | Fe2+的还原性比I-的还原性弱 |
| A. | A | B. | B | C. | C | D. | D |
15.具有下列电子层结构的原子和离子,其对应元素一定属于同一周期的是( )
| A. | 两原子N层上都有1个s电子,一个原子有d电子,另一个原子无d电子 | |
| B. | 最外层电子排布为2s22p6的原子和最外层电子排布为2s22p6的离子 | |
| C. | 原子核外M层上的s、p轨道都充满电子,而d轨道上没有电子的两种原子 | |
| D. | 两原子的核外全部都是s电子 |
2.生产、生活中离不开化学知识.下列说法正确的是( )
| A. | 汽车尾气、工业废气的排放是形成“雾霾”的主要原因 | |
| B. | 用铝制容器盛放浓硫酸,是因为铝和浓硫酸不反应 | |
| C. | 不锈钢比普通钢抗腐蚀能力强,是因为表面镀了一层铬 | |
| D. | “辽宁舰”用于舰载机降落阻拦索的是一种特种钢缆,属于新型无机非金属材料 |
12.亚硝酸钠(NaNO2)是一种工业盐,实验室可用如下装置(略去部分夹持仪器)制备.
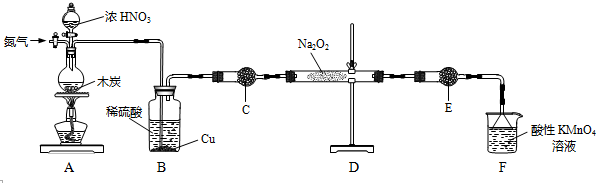
已知:①2NO+Na2O2→2NaNO2
②3NaNO2+3HCl→3NaCl+HNO3+2NO↑+H2O
③5NO${\;}_{2}^{-}$+2MnO${\;}_{4}^{-}$+6H+→NO${\;}_{3}^{-}$+2Mn2++3H2O
④NO和Na2O2都能使酸性高锰酸钾溶液褪色.
⑤实验结束后,将B瓶中的溶液经蒸发浓缩、冷却结晶、过滤可得CuSO4•5H2O.
(1)装置A中发生反应的化学方程式为C+4HNO3(浓) $\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+4NO2↑+2H2O.
(2)反应前检验装置气密性的操作为关闭活塞,用手捂住烧瓶底部,观察B中长导管液面是否下降,加热装置A前,先通一段时间N2,目的是排除装置内的空气.
(3)充分反应后,检验装置D中产物的方法是:取产物少许置于试管中,加入稀硫酸(或稀盐酸),试管内有气泡产生且在试管上方产生红棕色气体,则产物是NaNO2(注明试剂、现象).
(4)为测定产物中亚硝酸钠的含量,称取4.000g产物样品溶于水配成250mL溶液,取25.00mL溶液于锥形瓶中,用0.1000mol•L-1酸性KMnO4溶液进行滴定,实验所得数据如下表所示:
第一组实验数据出现异常,造成这种异常的原因可能是BD(填字母),
A.锥形瓶洗净后未干燥 B.滴定管用蒸馏水洗净后未用标准液润洗
C.振荡时有液体溅出来 D.锥形瓶用蒸馏水洗净后再用待测液润洗
(5)根据表中数据,计算出产物中亚硝酸钠的质量分数86.25%.
(6)设计合理实验比较0.1mol•L-1NaNO2溶液中NO${\;}_{2}^{-}$的水解程度和0.1mol•L-1HNO2溶液中HNO2的电离程度相对大小.(简要说明实验步骤、现象和结论,仪器和药品自选)方法①:配制浓度均为0.1 mol•L-1NaNO2和HNO2的混合液,测溶液的pH,若pH大于7,则NO2-的水解程度大于HNO2的电离程度,若pH<7,则NO2-的水解程度小于HNO2的电离程度.方法②:用pH试纸或pH计分别测定0.1 mol•L-1NaNO2溶液和0.1 mol•L-1HNO2溶液的pH,若HNO2溶液中氢离子浓度大于NaNO2溶液中的氢氧根浓度,则NO2-的水解程度小于HNO2的电离程度,反之,NO2-的水解程度大于HNO2的电离程度.

已知:①2NO+Na2O2→2NaNO2
②3NaNO2+3HCl→3NaCl+HNO3+2NO↑+H2O
③5NO${\;}_{2}^{-}$+2MnO${\;}_{4}^{-}$+6H+→NO${\;}_{3}^{-}$+2Mn2++3H2O
④NO和Na2O2都能使酸性高锰酸钾溶液褪色.
⑤实验结束后,将B瓶中的溶液经蒸发浓缩、冷却结晶、过滤可得CuSO4•5H2O.
(1)装置A中发生反应的化学方程式为C+4HNO3(浓) $\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+4NO2↑+2H2O.
(2)反应前检验装置气密性的操作为关闭活塞,用手捂住烧瓶底部,观察B中长导管液面是否下降,加热装置A前,先通一段时间N2,目的是排除装置内的空气.
(3)充分反应后,检验装置D中产物的方法是:取产物少许置于试管中,加入稀硫酸(或稀盐酸),试管内有气泡产生且在试管上方产生红棕色气体,则产物是NaNO2(注明试剂、现象).
(4)为测定产物中亚硝酸钠的含量,称取4.000g产物样品溶于水配成250mL溶液,取25.00mL溶液于锥形瓶中,用0.1000mol•L-1酸性KMnO4溶液进行滴定,实验所得数据如下表所示:
| 滴定次数 | 1 | 2 | 3 | 4 |
| KMnO4溶液体积/mL | 20.60 | 20.02 | 20.00 | 19.98 |
A.锥形瓶洗净后未干燥 B.滴定管用蒸馏水洗净后未用标准液润洗
C.振荡时有液体溅出来 D.锥形瓶用蒸馏水洗净后再用待测液润洗
(5)根据表中数据,计算出产物中亚硝酸钠的质量分数86.25%.
(6)设计合理实验比较0.1mol•L-1NaNO2溶液中NO${\;}_{2}^{-}$的水解程度和0.1mol•L-1HNO2溶液中HNO2的电离程度相对大小.(简要说明实验步骤、现象和结论,仪器和药品自选)方法①:配制浓度均为0.1 mol•L-1NaNO2和HNO2的混合液,测溶液的pH,若pH大于7,则NO2-的水解程度大于HNO2的电离程度,若pH<7,则NO2-的水解程度小于HNO2的电离程度.方法②:用pH试纸或pH计分别测定0.1 mol•L-1NaNO2溶液和0.1 mol•L-1HNO2溶液的pH,若HNO2溶液中氢离子浓度大于NaNO2溶液中的氢氧根浓度,则NO2-的水解程度小于HNO2的电离程度,反之,NO2-的水解程度大于HNO2的电离程度.
19.下列有关命名的说法正确的是( )
| A. | 按系统命名法,有机物 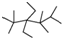 的命名为2,3,3,5,5五甲基-4,4-二乙基己烷 的命名为2,3,3,5,5五甲基-4,4-二乙基己烷 | |
| B. |  主链上的碳原子数是5 主链上的碳原子数是5 | |
| C. | 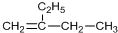 加氢后可以得到3-甲基戊烷 加氢后可以得到3-甲基戊烷 | |
| D. |  的名称是1,3,4-三甲基苯 的名称是1,3,4-三甲基苯 |
16. 硝基苯是重要的精细化工原料,是医药和染料的中间体,还可作有机溶剂.
硝基苯是重要的精细化工原料,是医药和染料的中间体,还可作有机溶剂.
制备硝基苯的过程如下:
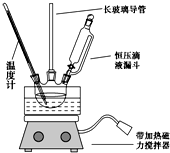
①组装如图反应装置.配制混酸,取100mL烧杯,用20mL浓硫酸与18mL浓硝酸配制混酸,加入漏斗中,把18mL苯加入三颈烧瓶中.
②向室温下的苯中逐滴加入混酸,边滴边搅拌,混合均匀.
③在50~60℃下发生反应,直至反应结束.
③除去混酸后,粗产品依次用蒸馏水和10% Na2CO3溶液洗涤,最后再用蒸馏水洗涤得到粗产品.
已知(1)
 HNO3(浓)$→_{98%浓H_{2}SO_{4}}^{50~60℃}$
HNO3(浓)$→_{98%浓H_{2}SO_{4}}^{50~60℃}$ +H2O
+H2O
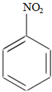 +HNO3(浓)$→_{98%浓H_{2}SO_{4}}^{95℃}$
+HNO3(浓)$→_{98%浓H_{2}SO_{4}}^{95℃}$ +
+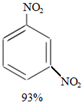 +
+
(2)可能用到的有关数据列表如下
请回答下列问题:
(1)配制混酸应在烧杯中先加入浓硝酸.
(2)恒压滴液漏斗的优点是可以保持漏斗内压强与发生器内压强相等,使漏斗内液体能顺利流下.
(3)实验装置中长玻璃管可用冷凝管(球形冷凝管或直行冷凝管均可)代替(填仪器名称).
(4)反应结束后,分离混酸和产品的操作方法为分液.
(5)用10%Na2CO3溶液洗涤之后再用蒸馏水洗涤时,怎样验证液体已洗净?取最后一次洗涤液,向溶液中加入氯化钙,无沉淀生成,说明已洗净.
(6)为了得到更纯净的硝基苯,还需先向液体中加入CaCl2(填化学式)除去水,然后采取的实验操作是蒸馏.
 硝基苯是重要的精细化工原料,是医药和染料的中间体,还可作有机溶剂.
硝基苯是重要的精细化工原料,是医药和染料的中间体,还可作有机溶剂.制备硝基苯的过程如下:
①组装如图反应装置.配制混酸,取100mL烧杯,用20mL浓硫酸与18mL浓硝酸配制混酸,加入漏斗中,把18mL苯加入三颈烧瓶中.
②向室温下的苯中逐滴加入混酸,边滴边搅拌,混合均匀.
③在50~60℃下发生反应,直至反应结束.
③除去混酸后,粗产品依次用蒸馏水和10% Na2CO3溶液洗涤,最后再用蒸馏水洗涤得到粗产品.
已知(1)
 HNO3(浓)$→_{98%浓H_{2}SO_{4}}^{50~60℃}$
HNO3(浓)$→_{98%浓H_{2}SO_{4}}^{50~60℃}$ +H2O
+H2O +HNO3(浓)$→_{98%浓H_{2}SO_{4}}^{95℃}$
+HNO3(浓)$→_{98%浓H_{2}SO_{4}}^{95℃}$ +
+ +
+
(2)可能用到的有关数据列表如下
| 物质 | 熔点/℃ | 沸点/℃ | 密度(20℃) | 溶解性 |
| 苯 | 5.5 | 80 | 0.88 | 微溶于水 |
| 硝基苯 | 5.7 | 210.9 | 1.205 | 难溶于水 |
| 1,3二硝基苯 | 89 | 301 | 1.57 | 微溶于水 |
| 浓硝酸[来] | - | 83 | 1.4 | 易溶于水 |
| 浓硫酸 | - | 338 | 1.84 | 易溶于水 |
(1)配制混酸应在烧杯中先加入浓硝酸.
(2)恒压滴液漏斗的优点是可以保持漏斗内压强与发生器内压强相等,使漏斗内液体能顺利流下.
(3)实验装置中长玻璃管可用冷凝管(球形冷凝管或直行冷凝管均可)代替(填仪器名称).
(4)反应结束后,分离混酸和产品的操作方法为分液.
(5)用10%Na2CO3溶液洗涤之后再用蒸馏水洗涤时,怎样验证液体已洗净?取最后一次洗涤液,向溶液中加入氯化钙,无沉淀生成,说明已洗净.
(6)为了得到更纯净的硝基苯,还需先向液体中加入CaCl2(填化学式)除去水,然后采取的实验操作是蒸馏.
17.X、Y、Z、W是原子序数依次增大的四种短周期元素,已知X、Z,Y、W分别位于同一主族,X与Z形成的离子化合物能与X、Y形成的常见液态共价化合物反应生成X2单质,Y、W两元素可形成两种常见的化合物,以下说法正确的是( )
| A. | X、Y、Z、W四种元素形成的化合物,其水溶液一定显强酸性 | |
| B. | Y、W的氢化物的稳定性后者强于前者 | |
| C. | X、Y、Z、W形成的简单离子半径大小依次增大 | |
| D. | Z的单质可与X、Y形成的共价化合物反应生成X2单质 |
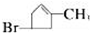 .化合物A~H的转化关系如图所示,B1和B2互为同分异构体,B1的摩尔质量80g/mol;G1和G2互为同分异构体,核磁共振氢谱显示二者均只有两种氢,G1无甲基.请完成下列问题.
.化合物A~H的转化关系如图所示,B1和B2互为同分异构体,B1的摩尔质量80g/mol;G1和G2互为同分异构体,核磁共振氢谱显示二者均只有两种氢,G1无甲基.请完成下列问题.
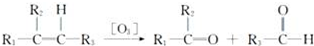
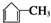 ,G2所含官能团为醛基、羰基.
,G2所含官能团为醛基、羰基.
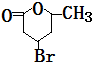 +H2O.
+H2O.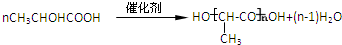 .
.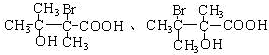 任意一种.
任意一种.